コア コンセプト
このチュートリアルでは、さまざまな酸塩基理論を比較対照します。 Arrhenius 理論と Bronsted-Lowry 理論を紹介します 、およびアレニウス酸とブレンステッド-ローリー酸 (ブレンステッド酸) のアイデア。
ルイス酸と塩基のチュートリアルをチェックして、ルイス理論について学びましょう!
他の記事で取り上げるトピック
- 酸塩基化学
- pHの定義
- 強酸と強塩基
- 酸と塩基の性質
- 正味のイオン方程式
- 共通イオン効果
- 酸塩基中和反応
- Ksp – 溶解積定数
酸塩基理論とは?
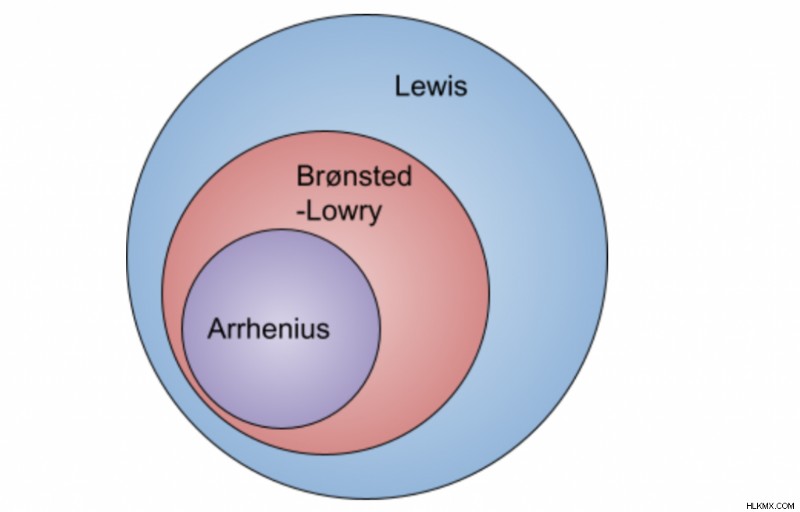
化学には 3 つの異なる酸塩基理論があります。これらの理論のそれぞれには、酸塩基反応と見なされるものについて独自の定義があります。以下の各理論のさまざまな条件を学びましょう!
アレニウスの酸と塩基
この理論では、酸と塩基の両方を水中で解離できる化合物と定義しています。つまり、対応するイオンに分解します (つまり、HBr → H + Br)。
アレニウス酸 は、溶液中で H+ イオンを生成する化合物です。硝酸、HNO3 、解離して H を生成するため、アレニウス酸の例です。 そしてNO3 イオン。水素イオンは水と結合して H
H-A(aq) → H(aq) + A(aq)
H-A (aq) + H2 O (l ) → H3 O(aq) + A(aq)
一方、アレニウス塩基は、溶液中でOHイオンを生成する化合物です。水酸化カリウム (KOH) は、解離して K と OH を生成するため、アレニウス塩基です。
B-OH (aq) → B(aq) + OH(aq)
さらに、H イオンと OH イオンも反応して水を生成するため、溶液内で中和が起こります。
H(aq) + OH(aq) → H2 O(l )
アレニウス理論は、3 つの理論の中で最も特異性が高く、酸または塩基とラベル付けするには H または OH イオンのいずれかが存在する必要があると述べているためです。ただし、これは他の理論では当てはまりません。より多くの化合物を含むより一般的な理論、つまりブレンステッド・ローリー酸の概念に移りましょう。
ブレンステッド・ローリー酸と塩基
この酸と塩基の定義は、水を含む溶液と含まない溶液の両方を分析するために使用できます。それは、化合物がどれだけ陽子を受け入れたり、供与したりできるかに関係しています.
ブレンステッド・ローリー酸、別名ブレンステッド酸はプロトン供与体であり、プロトンを放出できることを意味します。酸が溶液中で解離すると、H+ 収率が増加します。繰り返しますが、硝酸、HNO3 、解離して H+ を生成するため、酸として分類できます そしてNO3
H-A(aq) → H(aq) + A(aq)
H-A(aq) + H2 O(l ) → H3 O(aq) + A(aq)
ブロンステッド・ローリー塩基、別名ブロンステッド塩基はプロトンアクセプターです。塩基が解離すると、水からプロトンを取り、溶液中に OH イオンを生成します。 NH3もそう 酸か塩基か?アンモニア、NH3 は、NH4 の生成物を形成するために水からプロトンを取るため、塩基の例です。 そしてああ。
B(aq) + H2 O(l ) → B-H(aq) + OH(aq)
この理論では、水は酸または塩基のいずれかになります。これは、プロトンを受け入れて H3 を形成できるためです。 Oまたはプロトンを供与してOHを形成します。化合物がブレンステッド-ローリー酸または塩基の両方として機能する場合、両性であると言われます .
ブレンステッド・ローリー理論は、アレニウス理論に追加されます。 H イオンと OH イオンを生成する一般的な考え方は同じですが、この理論はより一般的であり、より多くの化合物を酸または塩基として標識することができます。たとえば、水からプロトンを取得すると水酸化物イオンが形成されるため、塩基は OH を含む必要はありません (アレニウス理論では必要です)。
ルイス酸と塩基理論
この理論は特異性が最も低く、酸と塩基の幅広い選択を可能にします。ルイス酸は電子対受容体であり、ルイス塩基は電子対供与体です。プロトンまたは水素については言及されていないため、このカテゴリに適合する化合物が増える可能性があります。ルイス理論では、ルイス塩基は、ルイス酸と共有または使用される電子対を供与すると述べています。詳細については、ルイス酸と塩基のチュートリアルをお読みください!
さらに読む
- 化学反応を簡単に
- 酸化還元反応
- 重量パーセント計算







