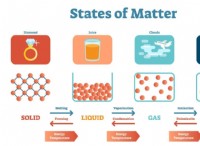
電子の発見が原子の積極的に帯電した部分の理解にどのようにつながったかは次のとおりです。
1。原子は電気的に中立です: 物質の基本的な構成要素である原子は、電気的に中性であることが知られていました。これは、彼らが全体的な料金を抱えていないことを意味します。
2。負に帯電した粒子の発見: トムソンの実験は、原子が現在電子として知られている負に帯電した粒子を含むことを示しました。
3。電荷のバランス: 原子に負電荷(電子)が含まれている場合、バランスをとるには対応する正電荷が必要であり、全体的な中立性を維持する必要があります。
4。 Thomsonの「Plum Pudding」モデル: この推論に基づいて、トムソンは原子の「プラムプリン」モデルを提案しました。彼は、原子がプリンの梅のように、その中に埋め込まれた電子を備えた正の帯電物の球体として想像しました。
5。ラザフォードのゴールドフォイル実験: 1911年、アーネストラザフォードの有名なゴールドフォイル実験がプラムプリンモデルを反証しました。ラザフォードは、薄い金箔で発射されたアルファ粒子(正に帯電した粒子)のごく一部が大きな角度で偏向し、一部は跳ね返ることさえあることを観察しました。この予期しない結果は、原子内の正電荷が核と呼ばれる小さな密な領域に集中していることを示唆しています。
6。核: ラザフォードの実験は、原子の核モデルの発達につながりました。そこでは、陽子と中性子を含む正に帯電した核が、それを周回する負に帯電した電子に囲まれています。
したがって、電子の発見は、正電荷の存在を直接証明しませんでした。代わりに、原子内の電荷バランスの問題を提起し、それがさらなる実験と原子の構造の最終的な理解につながりました。