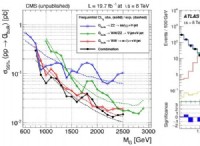
* 静電引力: カルシウム(CA)は金属であり、安定した電子構成を実現するために2つの電子を失う傾向があります。塩素(CL)は非金属であり、安定した構成を達成するために1つの電子を獲得する傾向があります。カルシウムと塩素が反応すると、カルシウムは2つの電子を失い、正に帯電したカルシウムイオン(ca²⁺)を形成し、それぞれ2つの塩素原子が1つの電子を獲得し、2つの負に帯電した塩化物イオン(Cl⁻)を形成します。イオンの反対の電荷は互いに強く惹かれ、イオン結合を形成します。
* 電気陰性の差: カルシウムと塩素の電気陰性の違いは大きい。カルシウムの電気陰性度は1.00、塩素の電気陰性度は3.16です。電気陰性度のこの有意な違いは、塩素がカルシウムから電子を引き付ける強い傾向を示し、イオンの形成につながります。
* クリスタル格子構造: CaCl₂のようなイオン化合物は、正に帯電したカルシウムイオンと負に帯電した塩化物イオンが繰り返しパターンで配置される結晶格子構造を形成します。この構造は、反対に帯電したイオン間の強い静電力によって結合されます。
要約: 金属と非金属の元素の組み合わせ、大きな電気陰性度の違い、および結晶格子構造の形成はすべて、イオン化合物として分類されるCACL₂に寄与します。