主な違い – 遷移金属と内部遷移金属
元素の周期表は、金属、非金属、半金属で構成されています。化学元素は、可鍛性、良好な電気伝導性、電子を容易に除去するなどの金属特性を有する場合、金属として分類されます。遷移金属および内部遷移金属も、電子配置を考慮してそのように分類される金属元素です。ほとんどの d ブロック元素は遷移金属と見なされます。 F ブロック元素は内部遷移金属と見なされます。遷移金属と内部遷移金属の主な違いは、遷移金属原子は最も外側の d 軌道に価電子を持つのに対し、内部遷移金属原子は最後から 2 番目の電子殻の f 軌道に価電子を持つことです。>
対象となる主な分野
1.遷移金属とは
– 電子構成に関連する定義、プロパティ
2.内部遷移金属とは
– 電子構成に関連する定義、プロパティ
3.遷移金属と内部遷移金属の違いは何ですか
– 主な相違点の比較
重要な用語:アクチニド、D 軌道、F 軌道、内部遷移金属、ランタニド、遷移金属
遷移金属とは
遷移金属は、不対 d 電子を持つ原子で構成される化学元素です。これらの元素が作る安定した陽イオンでさえ、対になっていない d 電子を持っています。ほとんどの d ブロック要素は遷移金属です。ただし、スカンジウム (Sc) と亜鉛 (Zn) は、それらが形成する安定な陽イオンであっても不対 d 電子を持たないため、遷移金属とは見なされません。スカンジウムは唯一の安定な陽イオンとして Sc を形成し、d 電子はありません。 Zn は、唯一の安定なカチオンとして Zn カチオンを形成します。 d 個の電子がありますが、すべてペアになっています。
元素の周期表では、すべての遷移金属は d ブロック元素に含まれています。これらの d ブロック要素は、s ブロック要素と p ブロック要素の間に配置されます。 Sブロックの元素は金属です。 P ブロック要素は非金属です。したがって、d ブロック元素は金属から非金属への遷移を示し、遷移金属と呼ばれます。
遷移金属は、異なる酸化状態で異なる化合物を形成できます。遷移金属によって形成される陽イオンはすべてカラフルです。そのため、それらの金属でできた化合物も非常にカラフルです。同じ遷移金属元素によって形成される化合物は、異なる色で見られます。これは、同じ元素の異なる酸化状態が異なる色を示すためです.

図 1:さまざまなニッケル錯体の色
遷移金属は複雑な化合物を形成することがあります。それらは配位化合物と呼ばれます。遷移金属原子は、孤立電子対を中央の金属原子に供与する複数の配位子によって中心化されています。
内部遷移金属とは
内部遷移金属は、最後から 2 番目の電子殻の f 軌道にある価電子で構成される化学元素です。 F ブロック元素は、f 軌道の価電子で構成され、それらの f 軌道が他の原子軌道に囲まれているため、内部遷移金属として知られています。
ランタニド系列とアクチニド系列は、f ブロックの 2 つの期間です。ランタニド系列は、4f 軌道に価電子を持つ化学元素で構成されています。アクチニド系列は、5f 軌道に価電子を持つ化学元素で構成されています。
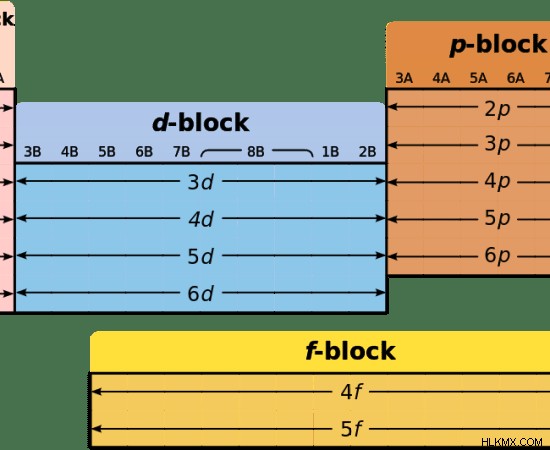
図 2:周期表のブロック
内部遷移金属は多数の殻を持つため、非常に大きな原子で構成されています。したがって、それらのほとんどは不安定で放射性です。ほとんどすべてのアクチニドは放射性元素ですが、ランタニドはいくつかの例外を除いて非放射性です.
内部遷移金属の最も顕著な酸化状態は +3 です。しかし、アクチノイドは最大で +6 の酸化状態を持つことができます。内部遷移金属は、57 から 103 までの範囲の原子番号を示します。
遷移金属と内部遷移金属の違い
定義
遷移金属: 遷移金属は、不対 d 電子を持つ原子で構成される化学元素であり、その安定な陽イオンでさえ不対 d 電子を持っています。
内部遷移金属: 内部遷移金属は、最後から 2 番目の電子殻の f 軌道に価電子を持つ化学元素です。
周期表の位置
遷移金属: 遷移金属は、周期表の d ブロックにあります。
内部遷移金属: 内部遷移金属は、周期表の f ブロックにあります。
原子番号
遷移金属: 遷移金属の原子番号は 21 から 112 です。
内部遷移金属: 内部遷移金属の原子番号は 57 から 103 です。
豊かさ
遷移金属: 遷移金属は地球上に豊富にあります。
内部遷移金属: 内部遷移金属は地球上ではあまり豊富ではありません.
最も顕著な酸化状態
遷移金属: 遷移金属の最も顕著な酸化状態は +2 です。
内部遷移金属: 内部遷移金属の最も顕著な酸化状態は +3 です。
結論
遷移金属と内部遷移金属は、原子番号が大きく原子サイズが大きい化学元素です。したがって、それらのほとんどは重金属と見なされます。遷移金属と内部遷移金属の主な違いは、遷移金属原子は最も外側の d 軌道に価電子を持つのに対し、内部遷移金属原子は最後から 2 番目の電子殻の f 軌道に価電子を持つことです。