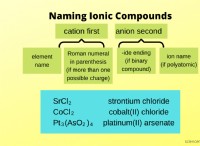
1。極結合:
* 極性共有結合: 異なる電気陰性度を持つ2つの原子が電子を共有すると、極性共有結合が形成されます。電気陰性度が高い原子は、共有電子をより強く引き付け、その原子に部分的な負電荷(Δ-)と他の原子に部分的な正電荷(Δ+)を生成します。
* 非極性共有結合: 2つの原子が同様の電気陰性度を持っている場合、電子ペアは均等に共有され、結合は非極性です。
2。分子形状:
* 対称形状: 分子に対称形状(四面体、線形、または三角平面など)がある場合、個々の結合双極子(原子の部分電荷)はしばしば互いにキャンセルします。これにより、極性結合がある場合でも、非極性分子が生じます。たとえば、co 2 2つの極C =O結合がありますが、線形形状により双極子がキャンセルされます。
* 非対称形状: 分子に非対称形状(曲がったものやピラミッド型など)がある場合、個々の結合双極子は互いにキャンセルしません。これにより、正味の双極子モーメントが作成され、分子極が発生します。たとえば、水(h 2 o)2つの極性O-H結合があり、その曲がった形状は正味の双極子モーメントになり、極性分子になります。
3。孤立ペアの効果:
*電子の孤立ペアは分子の形状に寄与し、極性に影響を与える可能性があります。それらはしばしば分子をより対称的な形状にし、それが正味の双極子モーメントをもたらし、分子極を作る可能性があります。
要約:
* 分子が極性になるには必要ではありませんが、十分ではありません。 分子は極性を持つことができますが、その形状が対称的である場合、まだ非極性です。
* 分子の形状は、個々の結合双極子がどのように相互作用するかを決定します。 If the dipoles cancel each other out due to symmetry, the molecule is non-polar.キャンセルしない場合、分子は極性です。
* 電子の孤立ペアは対称性を破壊し、分子の極性に寄与する可能性があります。
例:
* co <sub> 2 : 線形形状、極結合、非極性分子。
* h 2 O: 曲がった形状、極結合、極地分子。
* ch 4 : 四面体形状、極性C-H結合、非極性分子。
* nh 3 : ピラミッド型、極性N-H結合、極地分子(窒素の孤立ペアによる)。
分子の形と極性の関係を理解することは、分子の特性を予測し、それらが互いにどのように相互作用するかを理解するために重要です。