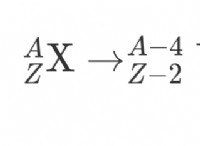1。分解反応を理解する
酸化ナトリウム(Na₂O)の分解は、次のバランスの取れた化学式で表されます。
2na₂o→4 na +o₂
これは、分解する2モルのNa₂oごとに、4モルのNaが得られることを意味します。
2。モル比を使用します
Na₂oとNaのモル比は2:4であり、1:2に簡素化されます。これは、1モルごとにNa₂oごとに2モルのNaを取得することを意味します。
3。 Na のモルを計算します
化学者は1.87モルのna₂oを持っているため、次のことを生成します。
1.87モルna₂o *(2モルna / 1モルナオオ)= 3.74モルのna
したがって、3.74モルのNaが形成されます。