pH は、物質がどの程度酸性または塩基性であるかの尺度です。私たちは日常生活の中で、pH の異なる多くの液体に出会い、飲んでいます。水は中性物質です。ソーダとコーヒーはしばしば酸性です。 pH は、物質同士や私たちの体との相互作用に影響を与えるため、重要な特性です。私たちの湖や海では、どの生物が水中で生き残ることができるかは pH によって決まります。 pH に関連する語彙、pH 式の使用方法、pH の計算方法、および pH が重要な測定値である理由を学びましょう!

pH とは?
pH は、物質がどの程度塩基性または酸性であるかの尺度です。 pH には 0 ~ 14 の範囲があります。 7 より大きい pH は、物質が塩基性であることを意味します。 7未満のpHは、その物質が酸性であることを意味します。物質が中性であることを示す pH が正確に 7 の場合。
酸性物質とは、陽子を放出するものです。塩基性物質はプロトンを受け取ります。酸と塩基の詳細については、この記事を参照してください。
pH 式は次のとおりです。
pH =-log ([H])
この pH の公式については、pH 公式の使用方法など、以下のセクションで詳しく説明します。
関連リンク
- 強酸と強塩基
- 酸と塩基の性質
- 酸塩基化学
- バッファ
- 酸塩基理論:アレニウス酸とブレンステッド-ラウリー酸
- 酸塩基中和反応
pHスケールとは?
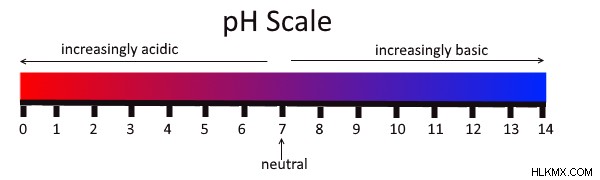
pH スケールは数字 0 から始まり、数字 14 で終わります。これらの数字は、pH に基づいて物質を分類することを可能にします。最も酸性の物質は 0 に近く、最も塩基性またはアルカリ性の物質は 14 に近くなります。pH が低いほど、より多くの H イオンが存在し、酸が強くなります。最も基本的な物質またはアルカリ性物質は、7 から 14 の間の分類になります。
pHフォーミュラ
pH =−log ([H])
pHの式は上に示されています。 pH は、ヒドロニウム濃度の 10 を底とする負の対数として定義されます。
pH は、溶液中の水素イオン濃度の対数測定値です。 pH は対数スケールなので、pH を 1 上げると、H イオンの濃度を 10 倍することに相当します。したがって、pH 6 と pH 7 の違いは小さく聞こえるかもしれませんが、実際にはかなりの差があります。 pH 方程式の場合、水素イオンの濃度は常にモル濃度、つまり 1 リットルあたりの H のモル数です。
pHの計算方法
水素イオンの濃度がわかっている場合、pH の計算は単に pH 方程式に差し込むだけです。場合によっては、酸が溶液中で完全にイオンに解離するという問題が発生することがあります。これで、水素イオン濃度を知ることは簡単です。
例:HCl の 0.2 モル溶液が溶液中で完全に解離すると仮定します。これは、塩酸の各モルに対して、1モルのHイオンがあることを意味します。 (HCl は強酸なので、完全に解離します)。したがって、水素イオンの濃度は 0.2 M です。pH 式は、pH が水素イオン濃度の負の対数であることを示しています。これは 0.2 モル濃度です。次に、電卓を使用して 0.2 M を pH 式に代入します。
pH =-ログ ([H]) =– ログ (0.1) =0.699
酸が完全に解離せず、K
pH 式 – pH を H に変換
状況によっては、pH がわかっているため、H イオンのモル濃度に変換する必要があります。このためには、10 を負の pH で累乗して、最初の方程式の対数を逆にする必要があります。
[H] =10
この方程式を使用すると、溶液の pH が 7 の場合、[H] =10 M. 溶液の pH が 0 の場合、[H] =10 M =1M (1 モル溶液)、および溶液の pH が 14 の場合、[H] =10 M.
pHの測定
実験室、家庭、または野外で物質の pH を測定する方法はいくつかあります。
<オール>
<強い>2.リトマス紙: リトマス紙は、浸した溶液のpHに基づいて色が変わる薄い紙です。この pH インジケーターは、水槽の pH をテストするために、一部のペット用品店で見つけることができます。

<強い>3.化学指標: 化学指示薬は、pH の変化に応じて溶液の色を変える溶液に入れることができる化学物質です。一般的なものには、フェノールフタレイン、ブロムチモール ブルー、リトマスなどがあります。これらは正確な pH を示すものではありませんが、物質の pH を知るには優れた方法です。
<強い>4.その他多数: さまざまな方法で指標として機能する化学物質は他にもたくさんあります。自宅でテストする簡単な方法の 1 つは、キャベツ ジュースを使用することです。独自のキャベツ ジュース インジケーターを作成する手順については、こちらを参照してください。さまざまな物質の pH を調べるためのもう 1 つの優れたアクティビティも、ここで見つけることができます。
pOH
pOH という用語は pH に似ていますが、アルカリ度または塩基度、つまり溶液中の水酸化物イオン (OH-) の濃度を指します。 2 つのスケールの機能は同じですが、スケールが逆になっています。中性物質は pH との両方を持っています pOH は 7 です。ただし、pOH スケールでは、塩基性物質の pOH は 7 未満になります。pOH の式は、H の代わりに水酸化物の濃度を使用することを除いて、pH の式と同じです。
pOH =−log [OH]
水とその pH
純水の pH スケールは 7 で、中性を意味します。純水中では、水素イオンと水酸化物イオンの濃度はどちらも同じで、10 M です。
ただし、溶解した酸、塩基、または塩は、酸性または塩基性のいずれかになります。たとえば、海水の pH は約 8 になる傾向があります。コップ 1 杯の水でさえ、大気中の二酸化炭素が溶け込むため、pH が正確に 7 になることはありません。汚染物質も水の pH を変化させる可能性があるため、水の pH は、安全と研究の両方のために多くの状況で頻繁に監視されます。
Kw 化学
K
水がイオン化すると、水素イオン (H) と水酸化物イオン (OH) に分かれます。 H は単独では水中では不安定で、ヒドロニウムイオン (H3 O) ですが、便宜上、通常は H と呼びます。
水のイオン化定数は、水のイオンとして存在する度合いと分子として一緒に存在する度合いを表し、H の濃度に OH の濃度を掛けた値に等しくなります。
K
pK
室温で、K
pH + pOH =pK
なぜ pH が重要なのですか?
一部の化学反応は、特定の pH 条件下でのみ発生します。これは、H または OH が反応で反応物として作用するためです。他の場合では、酸または塩基が反応を触媒することができます。つまり、それらは反応速度に影響を与えます.
生物は多種多様な生化学反応とプロセスに依存しており、そのほとんどは特定の pH 範囲を必要とします。その結果、湖や川などの生態系は、地域の動植物の生化学にとって好ましい pH 条件下で繁栄します。
生態系のように、人体には特定の pH があり、体が実行するさまざまなタスクを適切に機能させることができます。私たちの血液にはある値が必要であり、消化液にはまったく異なる値 (はるかに酸性) が必要です。そうしないと、正常な生化学が機能しなくなり、深刻な健康問題を引き起こす可能性があります。幸いなことに、人間や他の多くの生物は緩衝された血液を持っているため、pH は簡単には変化しません。これが、アルカリ水または酸性ソーダのボトルを飲むと、血液がほぼ同じ状態に保たれ、不均衡の影響から安全に保たれる理由です!
あなたの血液に組み込まれたこのセーフティネットの別の結果は、アルカリ水に関連する一般的な健康上の利点がほとんど作り出されているということです.たとえあなたの血液が何らかの形で酸性に傾いていたとしても、pH 8 の水を飲んでもほとんど変化しません!
pH スケールに関する豆知識
- 酸にはレモンのような酸味があります
- ベースは苦味がする傾向があります
- Søren Peder Lauritz Sørensen は、1909 年に pH 式と pH スケールを考案しました。Sørensen は、カールスバーグ研究所で働くデンマークの化学者でした。
- 多くの洗浄剤は非常に塩基性です (pH> 10)。例としては、排水管クリーナー、漂白剤、アンモニア溶液などがあります。非常に塩基性または非常に酸性の物質の取り扱いには常に注意してください。
- 大気中の二酸化炭素の増加により、現在、海の pH が低下しています。つまり、酸性度が高まっています。 pH の変化は、海の生物に連鎖的な影響を及ぼします。このトピックの背景と活動については、こちらの記事をご覧ください。
さらに読む
- 比熱とは?
- 酸塩基中和反応
- 反応物とは?
- 化学結合とは?