プロセスを理解するために、溶解度を予測し、形成を沈殿させる方法の内訳を次に示します。
1。反応物を特定します:
*二重変位反応には、通常、イオンを交換する2つのイオン化合物(塩)が含まれます。
2。製品の予測:
*反応物の陽イオン(陽イオン)と陰イオン(陰イオン)を切り替えることにより、可能な生成物の化学式を書き込みます。
3。溶解度ルールを使用してください:
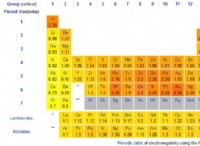
*溶解性ルールを使用して、どの製品が水に溶けているか、どの製品が不溶性(沈殿物を形成する可能性が高い)を決定します。いくつかの一般的な溶解度ルールは次のとおりです。
* 可溶性: グループ1カチオン(Li+、Na+、K+、Rb+、Cs+)およびアンモニウム(NH4+)を含むほとんどの塩は可溶性です。
* 可溶性: 硝酸塩(NO3-)と酢酸(CH3COO-)を含むほとんどの塩は可溶性です。
* 可溶性: ほとんどの塩化物(Cl-)、臭化物(Br-)、およびヨウ化物(I-)塩は、Ag+、Pb2+、およびHg22+を含むものを除き、溶けやすいです。
* 可溶性: ほとんどの硫酸塩(SO42-)塩は、Ba2+、Sr2+、Ca2+、Pb2+、およびHg22+を含むものを除き、可溶性です。
* 不溶性: ほとんどの炭酸塩(CO32-)、リン酸塩(PO43-)、および水酸化物(OH-)塩は不溶性ですが、グループ1カチオンとアンモニウム(NH4+)を含むものを除きます。
* 不溶性: ほとんどの硫化物(S2-)塩は、グループ1カチオン、グループ2カチオン、およびアンモニウム(NH4+)を含むものを除き、不溶性です。
4。沈殿物を決定します:
*溶解性規則に従って製品の1つが不溶性の場合、固体沈殿物が形成されます。
例:
反応: Agno3(aq) + naCl(aq)→?
製品: agcl(s) + nano3(aq)
溶解度:
* AgClは不溶性です(塩化物塩の規則に従って)。
* NANO3は可溶性です(硝酸塩の規則に従って)。
結論: 塩化銀(AGCL)の沈殿物が形成されます。
反応を提供したら、沈殿物を決定するためにステップを踏んでください!