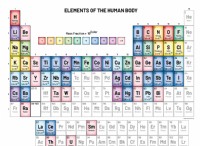
任意の要素の1モルには、Avogadroの数(6.022 x 10^23)の原子が含まれています。
原子質量は原子質量単位(AMU)で発現しています。 1つのAMUは、炭素-12原子の質量1/12と定義されています。
重要な接続は、AMUの元素の原子質量がグラムのその要素の1モルの質量に数値的に等しいことです。
これがどのように機能するかです:
* 例:炭素
*炭素の原子質量=12.01 AMU
* 1モルの炭素原子=12.01グラム
言い換えれば: 原子質量単位(AMU)は非常に小さな質量の単位です。日常の使用に実用的にするために、グラムを使用します。モルは、これら2つのユニット間の接続を提供します。
キーポイント:
* モル質量: 1モルの物質の質量はそのモル質量と呼ばれ、モルあたりのグラム(g/mol)で発現します。要素の場合、モル質量はその原子質量に数値的に等しくなります。
* Avogadroの番号: この一定は、原子と分子の微視的な世界をグラムとほくろの巨視的な世界に結び付けます。
* 計算: 原子質量、ほくろ、および質量の関係は、化学量論(化学反応における反応物と生成物の量に関連する量)を含む多くの化学計算に不可欠です。
要約: 元素の原子質量は、単一の原子の質量を原子の大規模なコレクション(1モル)の質量に直接関連付ける方法を提供します。この接続は、化学反応とプロセスを理解して定量化するために重要です。