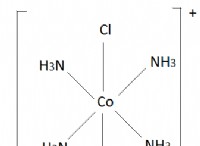
価電子
* 定義: これらは、原子の最も外側のエネルギーレベル(シェル)の電子です。彼らは化学結合に関与しているものです。
* 場所: アトムの最高エネルギーレベルで見つかりました。
* 役割: 原子が他の原子とどのように相互作用して化学結合を形成するかを決定します。
* 例: 酸素(O)には合計6つの電子があります。 2つは最初のシェルに、4つは2番目のシェル(価数シェル)にあります。酸素には4つのがあります 価電子。
Valency
* 定義: 原子が化学結合を形成するときに獲得、失い、または共有する電子の数。原子の結合容量を表します。
* 価電子電子との関係: 原子価は、価電子の数から *由来 *されています。
* タイプ:
* 正値性: 原子は原子価電子を失い、正のイオンを形成します。 (たとえば、ナトリウムは1つの電子を失うため+1の原子価があります)。
* 負の原子価: 原子は原子価電子を獲得して負のイオンを形成します。 (たとえば、塩素は1つの電子を獲得するため-1の原子価があります)。
* ゼロ値: 原子には完全な外側のシェルがあり、電子を獲得、失い、共有しません。 (たとえば、貴族の原子価はゼロです)
重要な違い
* 直接対派生: 価電子は *実際の *電子ですが、価数はそれらの電子に基づいて *概念 *です。
* 数量対容量: 価電子はカウントされますが、Valencyは原子の結合能力を説明します。
* 電子対結合: 原子価電子は結合に関与していますが、価はその結合挙動の *結果 *です。
例:
* 酸素: 4つの価電子がありますが、外側のシェルを完成させるために2つの電子を獲得するため、-2の原子価があります。
要約
価電子電子は化学結合のゲームの「プレーヤー」であり、原子価は「スコア」です。原子が他の人とどの程度効果的に相互作用するか。