主な違い – 酸化数と原子価
酸化数と原子価は、原子の価電子に関連しています。価電子は、原子の最も外側の殻または軌道を占める電子です。これらの電子は原子核に弱く引き付けられるため、簡単に失われたり、他の原子と共有されたりする可能性があります。この電子の損失、獲得、または共有により、特定の原子が酸化数と原子価を持つようになります。酸化数と原子価の主な違いは、原子の周りのすべての結合がイオン結合である場合、酸化数は配位化合物の中心原子の電荷であるのに対し、原子価は原子が失うことができる電子の最大数です。または、安定するために共有してください。
対象となる主な分野
1.酸化数とは
– 定義、計算、表現、例
2.ヴァレンシーとは
– 定義、計算、表現、例
3.酸化数と原子価の違いは何ですか
– 主な相違点の比較
重要な用語:アウフバウ原理、配位化合物、イオン結合、オクテット則、酸化数、価電子、原子価
酸化数とは
酸化数は、配位化合物の中心原子の周囲のすべての結合がイオン結合である場合の電荷です。配位錯体は、ほとんどの場合、錯体の中心にある遷移金属原子で構成されています。この金属原子は、配位子と呼ばれる化学基に囲まれています。これらの配位子は、配位結合を形成するために金属原子と共有できる孤立電子対を持っています。配位結合の形成後は、共有結合に似ています。これは、配位結合の 2 つの原子が共有結合のように電子対を共有しているためです。ただし、中心金属原子の酸化数は、配位結合をイオン結合とみなして計算します。
配位結合を形成するには、金属原子に空の軌道が必要です。遷移金属のほとんどは、空の d 軌道で構成されています。したがって、それらは配位錯体の中心金属原子として機能することができます。中心原子の酸化数はローマ数字で表されます。ローマ数字は中心原子の電荷を示し、括弧内に含まれています。たとえば、仮想金属原子「M」の酸化数が 3 の場合、酸化数は M(III) として与えられます。
酸化数を求める例を考えてみましょう。配位イオンの構造を以下に示します。
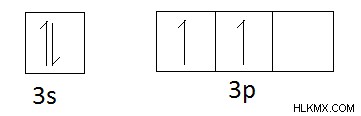
図 01:トランス [CoCl2(NH3)4]+
上記の調整イオンでは、全体の電荷は +1 です。したがって、配位子と中心原子の電荷の合計は +1 に等しくなければなりません。通常、塩素原子は -1 電荷を持ち、NH3 です。 中立です。
+1 =(コバルト原子の電荷) + (2 Cl 原子の電荷) + (4 NH3 の電荷 )
+1 =(コバルト原子の電荷) + (-1 x 2) + (0 x 4)
したがって、
コバルト原子の電荷 =(+1) – {(-2) + (0)}
=(+3)
したがって、コバルトの酸化数 =Co(III)
ヴァレンシーとは
原子価とは、原子が安定化するために失う、獲得する、または共有できる電子の最大数です。金属と非金属の場合、オクテット ルール 原子の最も安定した形を表します。原子の最外殻の数が 8 個の電子で完全に満たされている場合、その配置は安定であるということです。つまり、s と p の部分軌道が nsnp で完全に満たされていれば安定です。当然、希ガス原子はこの電子配置を持っています。したがって、他の要素は、オクテット規則に従うために、電子を失う、獲得する、または共有する必要があります。この安定化プロセスに関与する電子の最大数は、その原子の原子価と呼ばれます。
例として、シリコン元素を考えると、電子配置は 1s2s2p3s3p です。最外殻は n=3 です。そのシェル内の電子の数は 4 です。したがって、オクテットを完成させるには、さらに 4 つの電子を取得する必要があります。一般に、シリコンは他の元素と 4 つの電子を共有してオクテットを完成させることができます。
シリコンの軌道図、 
電子の再配置は、共有の前に発生します。 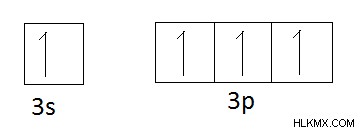
次に、電子の共有が発生します。 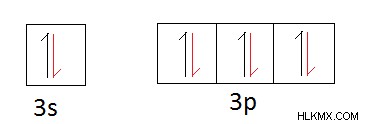
上の軌道図で、赤い半分の矢印は他の元素が共有する電子を表しています。シリコン原子は安定するために 4 つの電子を共有する必要があるため、シリコンの原子価は 4 です。
しかし、遷移金属元素の場合、価数は多くの場合 2 です。これは、軌道のエネルギー準位に従って電子が軌道に満たされるためです。たとえば、アウフバウの原則によると 、4s軌道のエネルギーは3d軌道のエネルギーよりも低いです。次に、電子は最初に4s軌道に満たされ、次に3d軌道に満たされます。最も外側の軌道の電子に対して価数が定義されるので、4s 軌道の電子はその原子の価数です。鉄 (Fe) を考えると、電子配置は [Ar]3d4s です。したがって、鉄の原子価は 2 (4 秒に 2 つの電子) です。しかし、鉄の原子価が 3 になることがあります。これは、3d よりも 3d の電子配置の方が安定しているためです。したがって、4s 電子とともにもう 1 つの電子を除去すると、鉄がより安定します。
酸化数と原子価の違い
定義
酸化数: 酸化数は、その原子の周りのすべての結合がイオン結合である場合、配位化合物の中心原子の電荷です.
価数: 価数は、原子が安定化するために失う、獲得する、または共有できる電子の最大数です。
申し込み
酸化数: 配位錯体には酸化数が適用されます。
価数: Valency はすべての要素に使用されます。
計算
酸化数: 酸化数は、配位子と配位錯体の全体的な電荷を考慮して計算できます。
価数: 原子価は、電子配置を取得することで決定できます。
表現
酸化数: 酸化数は括弧内のローマ数字で与えられます.
価数: 価数はヒンドゥーアラビア数字で与えられます。
結論
原子価の定義では、結合に使用される電子の最大数であるとされていますが、遷移元素は異なる原子価を持つことができます。これは、異なる数の電子を除去することで遷移金属を安定化できるためです。さらに、配位錯体の中心原子は、原子に結合している配位子に応じて異なる酸化数を持つことができます。