鉄は原子番号 26 で、元素記号は Fe です。
鉄は人間の生活に不可欠な元素であり、純粋な形でも合金でも見られます。赤血球や鋳鉄製調理器具のヘモグロビンに含まれています。元素記号 Fe で原子番号 26 の遷移金属である鉄に関する興味深い元素の事実を以下に示します。
興味深い鉄の事実
<オール>
純鉄の例 (Alchemist-hp)
天然の鉄は、4 つの安定同位体から構成されています。これらのうち、鉄 56 が最も多く、元素の 91.75% を占めています。鉄 57 だけが核スピンを持っています。多数の放射性同位体が生成されています (少なくとも 14 種類)。
鉄原子データ
-
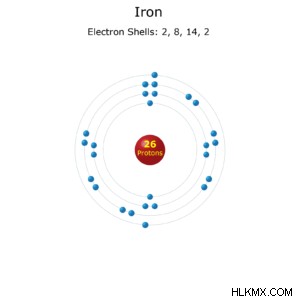
鉄原子
元素記号:鉄
- 原子番号:26
- 標準原子量:55.845(2)
- 外観:灰色がかった銀色の金属
- グループ:グループ 8 (遷移金属)
- 期間:期間 4
- ブロック:d ブロック
- 電子配置:[Ar]3d4s
- STP でのフェーズ:固体
- 融点:1811 K (1538 °C, 2800 °F)
- 沸点:3134 K (2862 °C, 5182 °F)
- 密度:7.874 g/cm (室温付近)
- 酸化状態:-4、-2、-1、+1、+2 , +3 , +4 , +5, +6 , +7 (太字が最も一般的)
- 電気陰性度:1.83 (ポーリング スケール)
- イオン化エネルギー:1st:762.5 kJ/mol; 2番目:1561.9 kJ/mol; 3 番目:2957 kJ/mol
- 原子半径:126 pm (経験的)
- 結晶構造:体心立方または顔心立方
- モース硬度:4
- 発見:紀元前5000年以前
参考文献
- Dlouhy、Adrienne C.; Outten、Caryn E. (2013)。 「第 8.4 章 鉄の取り込み、人身売買および貯蔵」。 Banci では、Lucia (編)。 「真核生物における鉄メタローム」。 メタロミクスと細胞 . 12.スプリンガー。 doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4.
- グリーンウッド、ノーマン N.;アーンショウ、アラン (1997)。 元素の化学 (第 2 版)。バターワース・ハイネマン。 ISBN 0-08-037941-9.
- Meija, J.;ら。 (2016)。 「元素の原子量 2013 (IUPAC テクニカル レポート)」。 純粋化学と応用化学 . 88 (3):265–91. doi:10.1515/pac-2015-0305
- 数週間、メアリー・エルビラ。レチェスター、ヘンリー M. (1968)。 「古代人に知られている要素」。要素の発見。ペンシルバニア州イーストン:Journal of Chemical Education . pp.29–40。 ISBN 0-7661-3872-0.