1。化学反応:
* あなたは起こっている化学反応を知っている必要があります。 例えば:
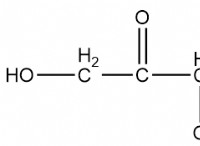
* 過酸化水素の分解: 2h₂o₂→2h₂o +o₂
* メタンの燃焼: ch₄ + 2o₂→co₂ + 2h₂o
2。反応物の量:
* 関係する反応物の量を知る必要があります。 これは:
* 質量(グラム): 反応物のモル質量を使用して、質量をモルに変換できます。
* ボリューム(リットル): 特定の温度と圧力のガスの場合、理想的なガス法(PV =NRT)を使用してモルの数を見つけることができます。
* moles直接: あなたがすでに反応物のほくろを知っているなら。
3。化学量論:
* バランスのとれた化学式は、反応物と生成物のモル比を教えてくれます。 化学式の前の係数を見てください。
例:
5グラムの過酸化水素(H₂O₂)が分解しているとしましょう。
1。バランスの取れた方程式: 2h₂o₂→2h₂o +o₂
2。h₂o₂のモル:
*h₂o₂=34 g/molのモル質量
*h₂o₂=5 g / 34 g / mol =0.147モルのモル
3。化学量論: この方程式は、2モルのh₂o₂が1モルのo₂を生成することを示しています。
4。o₂のモル: 0.147モルh₂o₂ *(1モルo₂ / 2モルh₂o₂)=0.0735モル
したがって、5グラムの過酸化水素は0.0735モルの酸素を生成します。
キーポイント:
* 常にバランスの取れた化学式から始めます。
* 化学量論係数に注意を払って、モル比を決定します。
* 必要に応じて反応物の量をモルに変換します。
* モル比を使用して製品のモルを計算します。