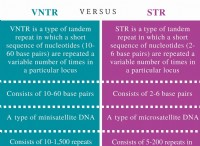
バッファシステム
* HF(ヒドロフルオロ酸) 弱酸です。
* naf(フッ化ナトリウム) コンジュゲートベース、F⁻(フッ化物イオン)を提供します。
強酸(HClなど)の追加
1。ベースとの反応: 強酸(HCl)は、緩衝液からフッ化物イオン(F⁻)と反応し、HFと塩化物イオン(Cl⁻)を形成します。
`` `
H⁺(aq) +f⁻(aq)⇌Hf(aq)
`` `
2。平衡のシフト: この反応は、いくつかのf⁻イオンを消費し、平衡が右にシフトし、より多くのHFの形成を支持します。
結果
* 最小化pH変化: 強酸を添加すると、溶液の酸性度が向上しますが、バッファシステムはpHの変化を最小限に抑えます。バッファーは、追加されたH⁺イオンを消費することで機能し、pHの劇的な減少を防ぎます。
重要なメモ
* バッファ容量: 緩衝液の有効性は、弱酸(HF)の共役塩基(F⁻)の比率に依存します。バッファーは、比率が不均衡になるまで、追加の酸またはベースを効果的に中和することができます。
* 強酸と強いベース: このバッファーソリューションに強力なベースを追加すると同様の反応が発生しますが、平衡は左にシフトし、HFを消費し、より多くのf⁻イオンを形成します。
全体式(簡素化):
`` `
HCl(aq) + naf(aq)⇌Hf(aq) + naCl(aq)
`` `
この単純化された方程式は、全体的な反応を示し、強酸(HCl)の消費と、より多くの弱酸(HF)の形成を強調しています。