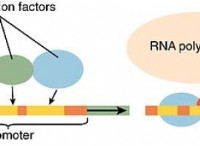
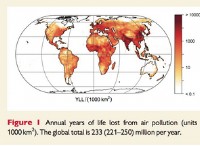
1。エネルギーの変化に基づいています
* 発熱反応: 周囲にエネルギーを放出し、しばしば熱や光を生成します。これらの反応は、エンタルピーに負の変化をもたらします(ΔH<0)。
* 吸熱反応: 周囲からエネルギーを吸収し、しばしば進行するために熱入力を必要とします。これらの反応は、エンタルピーに正の変化を抱えています(ΔH> 0)。
2。酸化状態の変化に基づいています
* 酸化還元反応: 反応物間の電子の伝達を伴い、酸化状態の変化につながります。
* 酸化: 電子の喪失、酸化状態の増加。
* 削減: 電子の獲得、酸化状態の減少。
3。反応物と生成物の性質に基づいています
* 併用反応(合成): 2つ以上の物質が結合して単一の製品を形成します。
例:2Na(s) +cl₂(g)→2nacl(s)
* 分解反応: 単一の化合物が2つ以上のより単純な物質に分解します。
例:2h₂o(l)→2h₂(g) +o₂(g)
* 単一変位反応: 1つの要素が化合物内の別の要素を置き換えます。
例:Zn(s) +cuso₄(aq)→znso₄(aq) + cu(s)
* 二重変位反応: 2つの化合物を交換し、2つの新しい化合物を形成します。
例:agno₃(aq) + naCl(aq)→agcl(s) +nano₃(aq)
* 燃焼反応: 酸化剤(通常は酸素)を含む物質を含む迅速な反応、熱と光を生成します。
例:ch₄(g) +2o₂(g)→co₂(g) +2h₂o(l)
* 中和反応: 酸と塩基が反応して塩と水を形成します。
例:HCl(aq) + naoh(aq)→naCl(aq) +h₂o(l)
* 降水反応: 2つの溶液が反応して不溶性固体(沈殿物)を形成します。
例:bacl₂(aq) +na₂so₄(aq)→baso₄(s) + 2nacl(aq)
4。反応のメカニズムに基づいて
* 求核反応: 求核試薬(電子豊富な種)は、電気泳動(電子不足種)を攻撃します。
* 電気症反応: 電気泳動が求核試薬を攻撃します。
* 添加反応: 2つ以上の分子が結合して単一の製品を形成します。
* 排出反応: 分子は原子または原子のグループを失い、新しい二重または三重結合を形成します。
5。他の要因に基づいています
* 均質反応: すべての反応物と製品は同じ段階にあります。
* 不均一反応: 反応物と製品はさまざまな段階にあります。
* 触媒: 消費されずに反応を加速する物質。
* 平衡反応: 前方と逆方向の両方で進行できる反応。
注意することが重要です: 一部の反応は、コンテキストに応じて複数の方法で分類できます。 これらの分類を理解することで、反応の産物を予測し、必要な条件を理解し、全体的なプロセスを分析することができます。