主な違い – 極性分子と非極性分子
異なる元素または同じ元素の原子が集まって分子を形成します。 2つの原子間で電子対を共有することによって形成される結合は、「共有結合」と呼ばれます。異なる原子は、さまざまな程度で電子への引力を示します。それらに向かって電子を引き寄せる能力は、電気陰性度と呼ばれます。 F、Cl、O などの原子は、C、P、S などの原子に比べて電気陰性度が大きくなります。電気陰性度の差が 0.4 未満の 2 つの原子が結合すると、極性分子が形成されます。原子間の電気陰性度の差が <0.4 の場合、分子は無極性になります。 主な違い 極性分子と非極性分子の間の正味の双極子モーメントです。 正味双極子モーメントは極性分子の原子で形成されますが、非極性分子では形成されません。
この記事では、
1.極性分子とは
– 定義、形成、プロパティ、例
2.非極性分子とは
– 定義、形成、プロパティ、例
3.極性分子と非極性分子の違いは何ですか 
極性分子とは
極性分子は、電気陰性原子の結果として、または同じ分子上の非極性結合と孤立電子対の非対称配置により形成されます。次の例では、2 つの現象をより詳細に説明します。
水分子: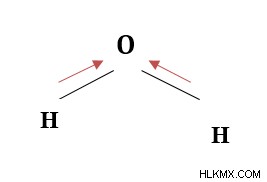
H と O の電気陰性度は、それぞれ 2.20 と 3.44 です。値の差は 1.24 であり、極性結合を形成する主な基準を満たしています。電子は、電気陰性度が比較的大きいO原子の方に引き付けられます。その結果、分子上に正味の双極子が存在します。 O はわずかに負 (δ-) であるのに対し、H 原子はわずかに正 (δ+) であると言われています。
分子の極性を決定する際には、分子の形状も重要な役割を果たします。二酸化炭素分子を考えることで、このシナリオをよりよく理解しましょう。
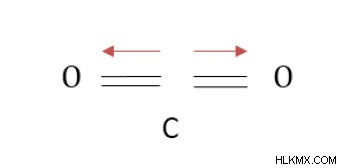
C は O よりも電気陰性度の低い原子 (2.55 および 3.44) であり、0.4 の電気陰性度の差の要件を満たします。ただし、分子の形状により、両方の C-O 結合の双極子モーメントは反対方向になり、互いに打ち消し合います。したがって、正味の双極子モーメントはゼロです。
極性分子は、一緒になると、原子の反対の電荷を介して互いに引き寄せられます。これらの力は、非極性分子間の力よりも強力ですが、イオン力よりも弱いです.
正に帯電した H 原子は、負に帯電した O 原子と水素結合を形成します。 H原子がそのような引力の形成に関与している場合、それらは水素結合と呼ばれ、水素原子の関与なしに形成された分子間力は双極子間力と呼ばれます.極性分子は、非極性溶媒では引力を形成できないため、極性溶媒にのみ溶解します。
極性化合物は、同様の分子量を持つ無極性化合物と比較して、より高い融点と沸点を示します。分子間結合を切断するには、エネルギーを供給する必要があります。したがって、融点と沸点は高いです。これにより、蒸気圧が低くなり、蒸発速度は非極性分子よりも低くなります。さらに、極性分子はより大きな表面張力を示します。
非極性分子とは
極性分子とは異なり、非極性分子には負電荷も正電荷もありません。これは、2 つの原子が共有する電子に対して同様の引力を持っているためです。 2 つの原子間の電気陰性度の差は <0.4 です。したがって、電子対は原子間に均等に分布しています。同じ元素のほとんどの二原子ガスは非極性分子です。例:– O2 , N2 、Cl2 など。メタン、ペンタン、ヘキサンなどの炭化水素分子は非極性分子です。
非極性分子は、電子の非対称分布によって引き起こされるロンドン分散力を示す場合があることに注意してください。これは自発的で一時的な力であり、すべての分子間力の中で最も弱いものです。これらのロンドン力は、非極性分子を非極性溶媒に溶解するのに十分です。ただし、これらの力は極性双極子力よりも弱いため、非極性分子が極性溶媒に溶解している場合、混合することはありません。代わりに、異種システムが形成されます。この場合、溶解プロセスはエネルギー的に有利ではありません。
同じ分子量の極性分子と比較して、非極性分子は強い分子間力がないため、融点と沸点が低くなります。さらに、分子は容易に蒸発するため、非極性化合物は高い蒸気圧を示します。したがって、ほとんどの非極性分子は揮発性化合物を形成します。
例:– ペンタン、ヘキサン
極性分子と非極性分子の違い
正味双極子
極性分子: 正味の双極子は、関与する原子の電気陰性度の違いまたは分子の非対称配置により存在します。
非極性分子: 同様の電気陰性度を持つ原子が含まれているため、または対称配置のため、正味の双極子は存在しません。
電気陰性度の違い
極性分子: 原子間の電気陰性度の差は <0.4.
非極性分子: 原子間の電気陰性度の差は>0.4 です。
分子力
極性分子: 分子力はかなり強く、H結合または双極子間結合を形成します。
非極性分子: 分子力は利用可能な中で最も弱いものです。ロンドンの分散した部隊を形成します。
物理的特性
極性分子: 極性分子は、沸点、融点が高く、蒸気圧が低く、表面張力が高い.
非極性分子: 非極性分子は、沸点、融点が低く、蒸気圧が高く、表面張力が低いです。
例
極性分子: 例には、水、HF、CHF3. などがあります。
非極性分子: 例としては、ペンタン、ヘキサン、二酸化炭素などがあります。
「分子 - 形成」。 原子、分子、物質、および種類 – JRank の記事 . N.p.、n.d.ウェブ。 2017.02.02「水処理ソリューション」 レンテック . N.p.、n.d.ウェブ。 2017 年 2 月 2 日。「極性分子と非極性分子:知っておくべきこと」。 Udemy ブログ . N.p.、n.d.ウェブ。 02 Feb. 2017.「非極性分子の特性は何ですか? | |ソクラテス。」 Socratic.org . N.p.、n.d.ウェブ。 2017 年 2 月 2 日。「ロンドン分散軍」。 ロンドン分散部隊 . N.p.、n.d.ウェブ。 2017.02.02.「無極性が無極性を溶かす?」 化学フォーラム . N.p.、n.d.ウェブ。 2017 年 2 月 2 日。 画像提供: CNX OpenStax による「図 02 01 11」(CC BY 4.0)、Commons Wikimedia 経由







