ロンドンの分散力
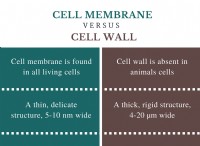
* 自然: 分子周辺の電子分布の一時的な瞬間的な変動から生じる最も弱い分子間力。
* 原因: 非極性分子でさえ、電子の瞬間的な不均一な分布を経験し、一時的な双極子を生成します。これらの一時的な双極子は、隣接する分子に双極子を誘導し、弱い魅力につながります。
* 強さ: 分子サイズと偏光の増加とともに非常に弱く、増加します(電子を歪むことができる方法)。
* 例: 貴族、炭化水素(メタン、エタン)。
双極子双極子相互作用
* 自然: 電子の不均一な共有のために永久双極子を持つ極性分子間で発生します。
* 原因: ある極性分子の正の端は、別の分子の負の端を引き付けます。
* 強さ: ロンドンの分散力よりも強いが、イオン結合と比較してまだ比較的弱い。
* 例: 水、アンモニア、塩化水素。
イオン結晶
* 自然: 積極的に帯電したイオン(陽イオン)と負に帯電したイオン(アニオン)の間の強力な静電魅力。
* 原因: ある原子から別の原子への電子の伝達を行い、反対の電荷を持つイオンの形成につながります。これらの反対の料金は強く惹かれます。
* 強さ: 非常に強く、イオン化合物の高い融点と沸点、硬度、脆性につながります。
* 例: 塩化ナトリウム(NaCl)、酸化カルシウム(CAO)、臭化カリウム(KBR)。
重要な違い
1。力の性質: ロンドンの分散力と双極子双極子の相互作用には一時的または永久的な双極子が含まれますが、イオン結晶には反対に帯電したイオン間の静電魅力が含まれます。
2。強さ: イオン結合は、ロンドンの分散力と双極子型相互作用よりも著しく強いです。
3。起源: ロンドンの分散力と双極子双極子の力は分子間力であり、分子の間に *存在する *を意味します。イオン結合は分子内の力です。つまり、分子の中に *存在します(またはより正確には、繰り返しイオン格子内)。
4。物理的特性: イオン結晶は、融点と沸点、硬度、脆性が高い。ロンドン分散と双極子型力を伴う分子化合物は、一般に剛性が低く、融点と沸点が低くなっています。
要約:
* ロンドン分散勢力と双極子双極子の相互作用: 分子化合物の物理的特性に影響を与える弱い分子間力。
* イオン結晶: イオン間の強い静電相互作用は、高い融点と他の特性特性を引き起こします。