アルカリ金属対遷移金属:重要な違い
アルカリ金属と遷移金属の主な違いの内訳は次のとおりです。
1。周期表の位置:
* アルカリ金属: 周期表の左端にあるグループ1(IA)。
* 遷移金属: 周期表の中央にあるグループ3-12(IIIB-IIB)。
2。電子構成:
* アルカリ金属: 1つの価電子(最も外側のシェルの電子)を持っています。彼らはこの電子を容易に失い、+1カチオンを形成します。
* 遷移金属: d軌道にさまざまな数の原子価電子があります。 S軌道とD軌道の両方から電子を失い、広範囲の酸化状態につながる可能性があります。
3。反応性:
* アルカリ金属: 反応性が高く、水、酸素、およびその他の非金属と容易に反応します。それらの反応性はグループの下に増加します。
* 遷移金属: 一般に、アルカリ金属よりも反応性が低い。それらの反応性は、元素とその酸化状態によって大きく異なります。
4。物理的特性:
* アルカリ金属: 溶融点と沸点が低い柔らかく銀色の金属。彼らは熱と電気の良い導体です。
* 遷移金属: 通常、融点と沸点が高く、硬く、密な金属。彼らはまた、熱と電気の良い導体です。
5。イオンの形成:
* アルカリ金属: +1カチオンを簡単に形成します。
* 遷移金属: さまざまな酸化状態により、さまざまな電荷でさまざまな陽イオンを形成します。
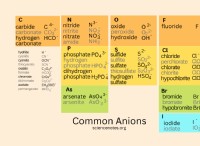
6。化合物:
* アルカリ金属: 非金属を持つイオン化合物を形成します。
* 遷移金属: 非金属を持つイオンおよび共有化合物の両方を形成します。また、複雑なイオンを形成することもできます。
7。例:
* アルカリ金属: リチウム(Li)、ナトリウム(NA)、カリウム(K)、ルビジウム(RB)、セシウム(CS)、フランシウム(FR)
* 遷移金属: スカンジウム(SC)、チタン(TI)、バナジウム(V)、クロム(CR)、マンガン(MN)、鉄(FE)、コバルト(CO)、ニッケル(NI)、銅(CU)、亜鉛(ZN)など。
要約: アルカリ金属は、1つの価電子を備えた高度な反応性金属であり、+1カチオンを容易に形成します。遷移金属は可変酸化状態を持ち、反応性が低く、さまざまな化合物を形成しています。