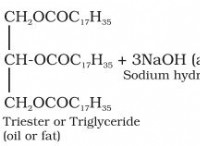酸
* 式の先頭に水素の存在(H): 酸は通常、寄付できる水素イオン(H+)を持っています。これが、彼らがしばしば「H」で始まる理由です。例えば:
* HCl(塩酸)
* H2SO4(硫酸)
* HNO3(硝酸)
* 非金属陰イオンの存在: 酸には通常、酸素(酸素を形成する)と組み合わせた非金属元素または塩化物(CL-)または臭化物(BR-)のような非金属アニオンが含まれます。
ベース
* フォーミュラにおける水酸化物(OH-)の存在: ベースを識別する最も一般的な方法は、水酸化物イオン(OH-)の存在によってです。これは、溶液中に水酸化物イオンを放出することが多いためです。
* NaOH(水酸化ナトリウム)
* KOH(水酸化カリウム)
* Ca(OH)2(水酸化カルシウム)
* 金属カチオンの存在: 水酸化物イオンに結合した金属元素は、通常、塩基を形成します。 ただし、例外があるため、これは完全なルールではありません。
* 陽イオンとしてのアンモニウム(NH4+): アンモニウムは非金属から形成された陽イオンですが、プロトン(H+)を受け入れることができるため、塩基として動作します。
重要な考慮事項
* hまたはohを持つすべての式は酸と塩基ではありません: Hを含むいくつかの化合物は酸ではない可能性があります(たとえば、CH4-メタン)。同様に、OHの一部の化合物は塩基ではない可能性があります(たとえば、CH3OH-メタノール)。
* コンテキストが重要: 考慮される反応の種類が、化合物が酸または塩基として作用しているかどうかを判断するのに役立つ場合があります。たとえば、水は反応に応じて酸とベースの両方として機能します。
特定の化学式がある場合は、識別に役立つ場合はお知らせください!