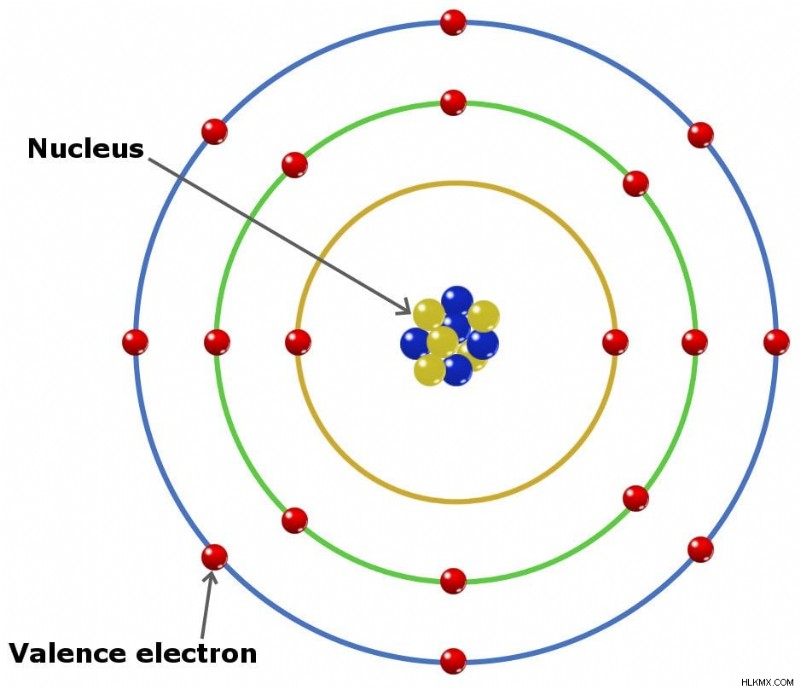
価電子は、原子核を囲む最外殻に存在する電子です。価電子は、元素の化学的性質に深い洞察を与えるため、非常に重要です。つまり、それが本質的に電気陰性か電気陽性か、または化学化合物の結合順序 (2 つの原子間で形成できる結合の数) を示します。
共有結合は最終的な殻で電子を共有することによって形成されるため、この数は形成される可能性のある結合の数を示します。
価電子とは?
価電子は、原子の最も外側の殻にある電子です。言い換えれば、これらは化学反応中に獲得または喪失できる電子です。
価電子はどこにありますか?
イオン結合、共有結合、金属結合など、原子間の化学結合の種類に関係なく、原子構造の変化は最外殻の電子、つまり価電子に限定されます。
最も基本的な方法は、元素の原子配置を参照して、最外殻の電子を単純に数えることです。ただし、知らない構成を見つけるために教科書を調べなければならない場合があるため、これは非常に骨の折れる作業です。
ただし、この切望された数を決定するはるかに簡単な方法があるため、心配する必要はありません.これは、より一般化されたアプローチであり、1 枚の小さな光り輝く長方形の紙 — 周期表 — を呼び出すだけで済みます。
元素の価電子数を決定するには、周期表を参照して元素の位置を検索するだけです。
価電子と周期表
周期表は、これまでに発見されたすべての元素をきれいに並べたものです。要素は、原子番号または含まれる陽子または電子の数の昇順で左から右に配置されます。

元素は、主族元素、遷移元素、ランタニド、アクチニドの 4 つのカテゴリに分類されます。後者の 2 つは、内部遷移とも呼ばれます。
テーブルには、正式には グループ と呼ばれる合計 18 列が含まれています。 行と同様に、正式には ピリオドとして知られています。 上のサブテーブルには 7 行あり、下の 2 行は希少元素を区別しています。移行要素は、ブリッジを形成するか、グループ 2 と 13 の要素間の移行を永続させます。
価電子を見つける方法
グループを下ると、殻の数は増えますが、価電子の数は同じままです。
期間全体の価電子は 1 ずつ増加しますが、殻の数は同じままです。要素が見つかる期間番号 (行番号) は、その核を取り囲む殻の数を示します。
では、グループ番号の意味は何ですか?
遷移元素以外の元素の価電子 – 主族元素
周期数は殻の数を示し、グループ数は最外殻の価電子の数を示します。具体的には、一の位の数字です。ただし、これは主なグループ要素 (グループ 1-2 および 13-18 に存在する要素) にのみ当てはまります。
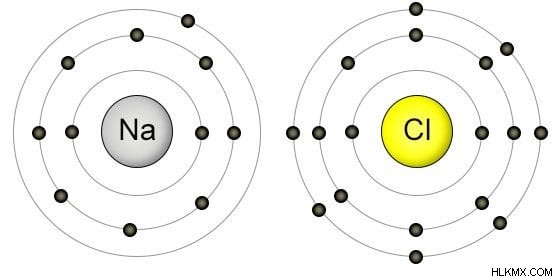
このルールは、トランジション要素と内部トランジション要素には適用できません (その理由についてはすぐに説明します)。たとえば、ナトリウム (Na) は周期 3、グループ 1 に存在します。これは、原子価殻に 3 つの殻と 1 つの電子があることを意味します。
または、17 族の塩素を考えることができます。したがって、その価電子を決定するためには、その 1 の場所の数のみを求める必要があります:7.予想どおり、それはまさにその価電子殻の電子の数です。 /P>
単純に周期表を参照して対応するグループ番号を決定するこの方法により、かつては個々の原子配置の骨の折れる検索に伴う面倒と複雑さが解消されました。
その間の元素の価電子はどうですか?もちろん、ランタニドとアクチニドを忘れてはなりません…
殻が電子で満たされる仕組みの簡単な説明
遷移元素は、主族元素で肩を並べる金属と大差ありません。それらは金属のように見えます。それらは展性があり、延性があり、熱と電気の両方を伝導できます。最良の 2 つの導体である銅 (Cu) とアルミニウム (Al) が遷移金属であるという事実は、それらの特性がどの程度重複しているかを示しています。
ただし、上記の方法から得られた結果は複製されません。グループ番号を参照するだけでは、価電子を数えることはできません。
この例外を理解するには、どのでも電子がどのように殻を占めるかを理解する必要があります
ただし、まず、原子核の周りに殻を埋める高校の方法を忘れる必要があります。2..8..8..18 などを覚えていますか?この特定の方法で電子を分配するのには理由があります。
原子の周りの電子の順序を説明する太陽系の例えは、完全に間違っています。すぐに削除する必要がありますが、実際の表示に関連する問題が軽減されるためual モデルとして、高校の教科書は主にこの初歩的な説明に依存しています。
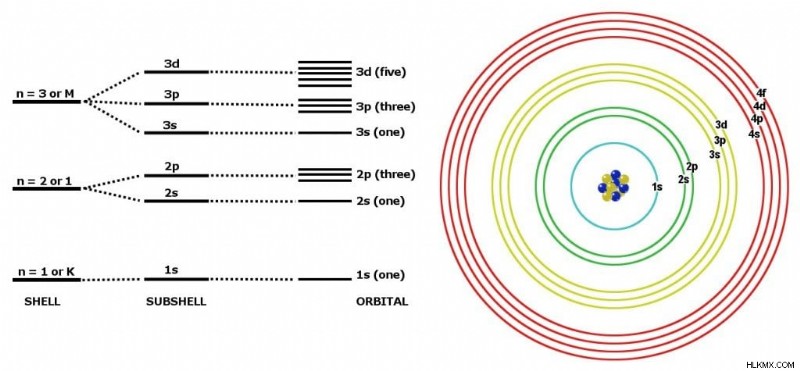
電子は、原子核の周りの硬い殻を占有しません。実際、核の周りの位置は非常に不確実です。それらは、核の周りの特定のエネルギーレベルのみを占めることができます.彼らはそこで見つかる可能性が最も高いです。技術的には、これらの準位は量子状態と呼ばれ、いわゆる量子数 n によって参照されます。 .
さて、次の文は偽善的に聞こえるかもしれませんが、量子数は私たちの古き良きシェルと考えることができますが、技術的には軌道 (s、p、d、f) として知られているサブシェルが含まれています。このように単純化しすぎているにもかかわらず、このような短期集中コースとしては非常にうまく機能します。
サブシェルが収容できる電子の数を制限する規則があります:s-2、p-6、d-10、および f-14。これで十分でない場合は、せん妄に加えて、シェルは以下に示す特定の順序でのみ満たすことができます.それをルールと呼びましょう .
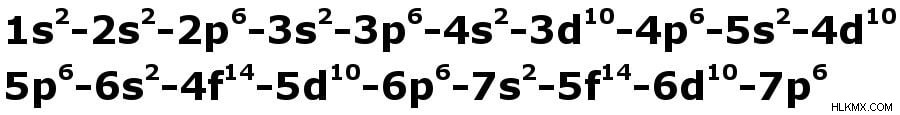
電子は、正確にこの順序で左から右に満たされる必要があるだけです。
上図のようにサブシェルの並び方に無意識に電子を振り分けると、原子番号20のカルシウム(Ca)は2,8,10(2,2+6, 2+6+2)。正確な構成は 2,8,8,2 であるため、どの高校の化学の教科書にも、これは正しくないと書かれています。
ただし、ルールを守らなければならないため、 3d の前に 4s を埋めなければならない 3 番目のシェルに 8 個、4 番目のシェルに 2 個あり、2,8,8,2 という構成になっています。出来上がり!リチャード・ファインマンが元気よく叫ぶように:物事を発見する喜び!悲しいことに、喜びは半分しか生きていません — ルールの理由 この明らかなばかげたこと自体は、この記事の範囲を超えています。
さて、シェルがどのように満たされるかがわかったので、遷移元素の価電子の数をさらに見つけることができます。
ランタニドとアクチニドの価電子 (遷移元素と内部遷移元素)
原子番号 21 のスカンジウム (Sc) について考えてみましょう。規則に従って電子を満たしてください。 21 番目の電子が 3d サブシェルを占めていることがわかります。ただし、先に満たされた第 4 殻 (4s) には 2 つの電子があり、明らかに最外殻であるため、価電子の数は 2 です。
同様に、第 4 周期のすべての遷移元素は 2 つの価電子を持っている必要があります。その理由は、3d が 4s よりも先に満たされても、4 番目の殻にある 2 つの電子は最外殻の住民であり、正当に価電子の指定に値するからです。
実際、これはすべての時代の移行要素に当てはまります。 6 番目の期間 (行) と 11 番目のグループ (列) にある金 (Au) を考えてみましょう。殻を埋める過程で、5dの詰め物の後に6sの詰め物が続くことがわかります。そして、第 6 殻は第 5 殻の上にあるため、価電子の数は… *ドラムロール*… 2!
ただし、これは電子が 理想的に ラインナップ。これらのシェル間のエネルギー差はごくわずかであり、電子 (または自然) は何よりも安定性を切望しています。電子は、より安定した構成を達成するために、比較的同等のエネルギーを持つ隣接するシェルに喜んでジャンプします。
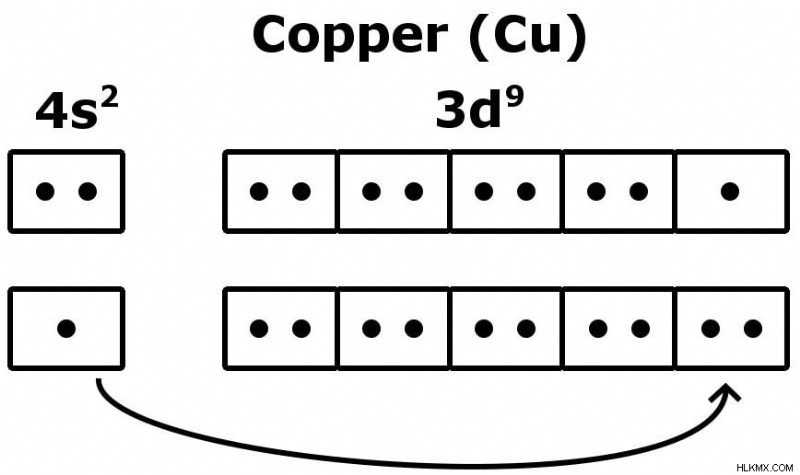
良い例は、気まぐれな銅 (Cu) 原子の配置です。
銅の価電子の奇妙なケース
銅は 29 個の電子を持っているので、最後尾の電子は …4s2-3d9 のように並んでいます。銅の場合、構成は少し不安定です — より安定した構成は、3d シェルに 10 個の電子を持つことであり、これはまさに私たちが観察したことです!
殻のエネルギーは同等であるため、4s の電子は 3d にジャンプして安定配置を実現します。価電子の数が 1 になりました!
遷移元素の中のいくつかの元素は、f、d、および s シェルのエネルギー準位が同等であるため、内部遷移元素でも観察されるこの奇妙さを示します。
要約すると、遷移元素と内部遷移元素の価電子数は予測不可能な方法で変化すると言えます。
遷移元素の価電子数はまだ予測できますが、そのほとんどは最終的に 2 になりますが、内部遷移元素のそのような予測は真似できません。
それらの価電子の気まぐれな挙動は、果てしなく震え、優柔不断にホップし、固有の安定した配置を得ようとするあらゆる試みを否定し、価電子の数を予測することをほとんど不可能にします!












