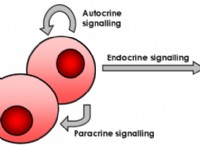
通常、モルへの変換が必要な理由は次のとおりです。
* 化学量論: 化学反応は、モルの比に基づいて発生します 、質量の比率ではありません。 バランスの取れた化学式の係数は、関連する各反応物と生成物のモルの相対数を表します。
* 異なるモル質量: 物質は異なるモル質量を持っています。 同じ質量を持つ2つの反応物は、モルの数が大きく異なる場合があります。ナトリウム100 g(NA)と100 gの塩素(Cl)を考慮してください。 それらの腫瘤は等しいが、ナトリウムは塩素よりもはるかに高いモル質量を持っているため、塩素のモルがかなり多く存在することを意味します。
これについて考える方法は次のとおりです。
1。レシピを想像してください: クッキーを焼いて、レシピでは小麦粉2杯と砂糖1杯を必要としています。小麦粉が1.5カップしかない場合、1カップ以上の砂糖があっても、クッキーの完全なバッチを作ることはできません。小麦粉は制限成分です。
2。モールに関連する: 化学では、ほくろはクッキーのレシピの「カップ」に似ています。バランスの取れた方程式は、反応の「レシピ」(モル比)を教えてくれます。化学量論比が必要とするよりも1つの反応物のモルが少ない場合、その反応物は制限されています。
モルなしで制限反応物を決定できる場合:
* 等臼歯腫瘤: 反応物が同じモル質量を持っている場合、質量を直接比較できます。より小さな質量との反応物は、制限反応物になります。
* 単純な比率: 反応物間の化学量論比が1:1であり、反応物が著しく異なるモル質量を持っている場合、しばしばモルに変換せずに制限反応物を推測することができます。
結論: モルへの変換は通常、制限反応物を決定するための最も安全で最も正確な方法です。バランスのとれた方程式の化学量論に直接関連する反応に関与する粒子(分子、原子)の数を保証します。