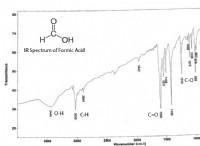
飽和の理解
* 飽和溶液: 特定の温度と圧力で溶解した溶質の最大量を含む溶液。 溶質を追加することは溶解しません。
* 溶解度: 特定の温度と圧力で特定の量の溶媒で溶解できる溶質の最大量。
溶液を飽和させる方法
1。溶質の追加:
* 溶媒(水分など)から始めます。
* かき混ぜながら溶質(砂糖、塩など)を徐々に追加します。
* 溶解するまで溶質を追加し続けます。 容器の底に溶解していない溶質が表示されます。
2。温度の変化:
* 溶解度は通常、温度とともに増加します。
* 溶液を熱: これにより、より多くの溶質が溶けることができます。
* ソリューションをゆっくりと冷却: 冷めると、溶解度が低下し、溶質の一部が沈殿します。 溶液は低温で飽和状態になります。
3。蒸発:
* 不飽和ソリューションから始めます。
* 溶媒を蒸発させます。 溶媒が蒸発すると、溶質の濃度が増加します。
* 最終的に、溶液は飽和状態になります。
覚えておくべき重要な点:
* 温度が重要: 溶解度は温度に依存します。 ある温度で飽和する溶液は、別の温度で飽和しない場合があります。
* 圧力問題: ガスの場合、溶解度は圧力の増加とともに増加します。
* 攪拌が役立つ: 溶液を攪拌すると、溶解プロセスが高速化されます。
* 溶解していない溶質: 溶解していない溶質の存在は、溶液が飽和している兆候です。
例:
砂糖溶液を作っていると想像してください。絶えず攪拌しながら、水に砂糖を加えます。最初は、砂糖は容易に溶けます。砂糖を追加し続けると、溶解するのが難しくなります。最終的に、あなたはこれ以上砂糖が溶解しないようにし、飽和糖溶液を持っています。