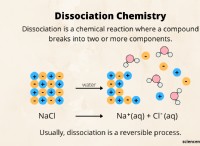
アルカリ塩基からの塩の調製と対照的な調製
アルカリ塩基からの塩の調製には、酸と反応することが含まれます。一般原則は同じですが、使用される特定のアルカリベースに応じていくつかの重要な違いがあります。
類似点:
* 中和反応: 両方の反応には、アルカリ塩と酸が反応して塩と水を形成する中和反応が含まれます。
* 発熱反応: 反応は通常発熱性であり、熱を放出します。
* pHの変化: 溶液のpHは、基本(アルカリベース)から中性またはわずかに酸性(塩溶液)に変化します。
違い:
|機能|アルカリ水酸化物(たとえば、NaOH)|アルカリ炭酸塩(例:Na2Co3)|
| --- | --- | --- |
|酸との反応 |酸との直接中和反応:NaOH + HCl→NaCl + H 2 o | 2段階の反応:
1。Na 2 co 3 + hcl→naCl + nahco 3 + h 2 o
2。NAHCO 3 + hcl→naCl + co <sub> 2 + h 2 o |
| 副産物 |副産物として生産されるのは水だけです。 |二酸化炭素は、2番目のステップで副産物として生成されます。 |
| 反応速度 |一般に、反応速度が高くなります。 | 特に2番目のステップでは、反応速度が遅くなります。 |
| インジケータ | Phenolphthaleinなどの指標を使用して、反応のエンドポイントを決定できます。 | メチルオレンジなどの指標を使用して、反応のエンドポイントを決定できます。 |
|塩の溶解度 |塩の溶解度は、使用される特定の酸とベースに依存します。 |塩の溶解度は、使用される特定の酸とベースに依存します。 |
例:
* NaOHからの塩化ナトリウム(NaCl):
* naoh(aq) + hcl(aq)→naCl(aq) + h 2 o(l)
* Na 2 からの塩化ナトリウム(NaCl) co 3 :
* Na 2 co 3 (aq) + 2hcl(aq)→2nacl(aq) + co <sub> 2 (g) + h 2 o(l)
キーポイント:
*アルカリ水酸化物は酸と直接反応して塩と水を形成します。
*アルカリ炭酸塩は2段階のプロセスで酸と反応し、副産物として二酸化炭素を生成します。
*アルカリベースと酸の選択により、生成された特定の塩が決定されます。
*反応速度と副産物は、使用されるアルカリベースによって異なる場合があります。
これらの違いを理解することは、製品を予測し、アルカリ塩基からの塩の調製の反応条件を制御するのに役立ちます。