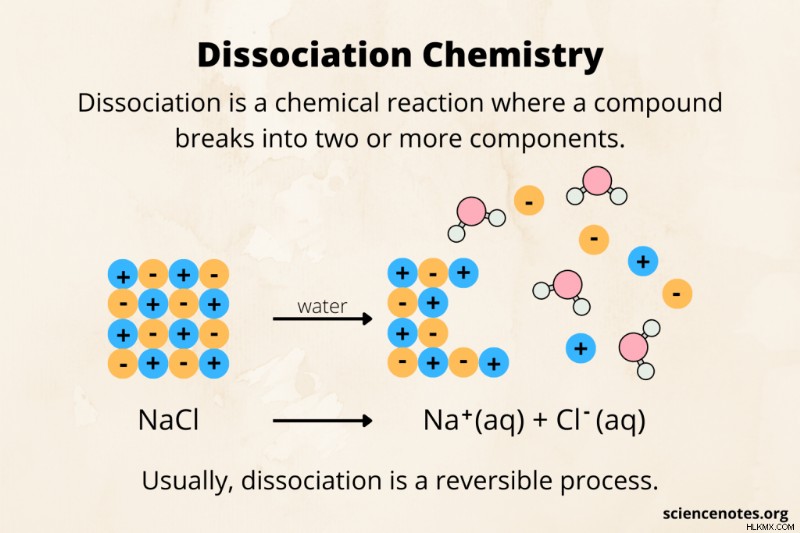
化学では、解離 分子または化合物が、イオン、原子、またはラジカルなどの小さな断片に分解される化学反応です。たとえば、塩酸 (HCl) は水中で解離し、H イオンと Cl イオンを形成します。通常、解離は可逆的なプロセスです。解離の逆は結合 または組換え .
解離式
解離の一般式は反応です:
AB ⇄ A + B
反応が可逆的であることを示す反応矢印に注意してください。ほとんどの場合、反応は陽イオンと陰イオンを形成します:
AB ⇄ A + B
一部の化合物では、2 つ以上の破片が発生します。
解離反応の例
以下は解離反応の例です:
- NaCl(s) ⇄ Na(aq) + Cl(aq)
- HCl ⇄ H(aq) + Cl(aq)
- H2 SO4 ⇄ 2H(aq) + SO4 (aq)
- Fe2 (SO4 )3 (s) ⇄ 2Fe(aq) + 3SO4 (aq)
- 2 H2 O ⇄ H3 O+ + オハイオ州
分子解離がイオン生成物を形成するとき、反応の別名はイオン化です .慣例により、水は水溶液中の反応の生成物としてリストされていません。代わりに、省略形 (aq) が製品の式に従います。
気体も解離します。たとえば、四酸化二窒素 (N2 O4 ) 二酸化窒素 (NO2 )、電気的に中性の製品を形成します:
N2 O4 ⇄ 2 NO2
一部の化合物は、解離に関してオプションがあり、さまざまな生成物を形成できます。たとえば、azo-t -ブタンは 3 つの可能な解離反応を受け、イオン化されたブテン、t を形成します。 -ブチルカチオンと中性ラジカル、または別のカチオンと中性 t -ブチル基。
解離定数
すべての化合物が解離する場合、これは完全な解離です。強力な電解質は水中で完全に解離します。強電解質の例には、強酸、強塩基、および塩が含まれます。ただし、不完全な解離が一般的です。不完全な解離は、元の化合物の一部と、より小さな粒子を含む混合物をもたらします。弱い電解質では不完全な解離が起こります。弱電解質には、弱酸や弱塩基、その他の有機化合物が含まれます。
溶解度は解離生成物の量に影響します。たとえば、一部の塩はほとんど溶けませんが、強力な電解質です。たとえば、塩化銀 (AgCl) は強力な電解質ですが、水にはほとんど溶けません。飽和 AgCl 溶液には、約 1.3 x 10 M の Ag および Cl イオンしか含まれていません!
解離度 (α) は、その成分に分かれる化合物の割合です。したがって、たとえば、完全解離の解離度は 1 です。化合物解離の半分の場合、解離度は 0.5 です。解離が起こらない場合、解離度は 0 です。
ファントホッフ係数 (i 解離度 (α) と形成される粒子のモル数 (n) の関係を説明します:
i =1 + α(n – 1)
たとえば、塩化ナトリウムの解離を考えてみましょう:
NaCl ⇄ Na + Cl
1 モルの NaCl は、2 モルの生成物 (1 モルの Na と 1 モルの Cl) を生成します。したがって、n =2 です。
i =1 + α(n – 1) =1 + α(2 – 1) =1 + α
α =i – 1
解離定数
化学平衡での可逆解離の場合、解離定数 (K
AB ⇄ A + B
K
参考文献
- アトキンス、P.; de Paula、J.(2006)。 物理化学 (第8版)。 W.H.フリーマン。 ISBN 978-0-7167-8759-4.
- レイドラー、K.J. (1978)。 生物学的応用を伴う物理化学 .ベンジャミン/カミングス。 ISBN 978-0-8053-5680-9。
- ペトルッチ、ラルフ H.;ハーウッド、ウィリアム・S。 Herring, F. Geoffrey (2002)。 一般化学:原理と最新の応用 (第8版)。ニュージャージー州アッパーサドルリバー:プレンティスホール。 ISBN 978-0-13-014329-7.







