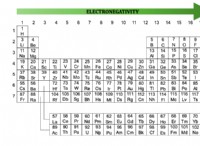
核:原子の中心
* 陽子: 核に見られる正に帯電した粒子。プロトンの数は要素を定義します。たとえば、すべての炭素原子には6つのプロトンがあります。
* 中性子: 核に見られる中性帯電した粒子。中性子の数は元素内で異なる場合があり、同位体につながります。
電子雲:核を囲む
* 電子: しばしばシェルまたは軌道として視覚化される特定のエネルギーレベルで核を周回する負に帯電した粒子。
* エネルギーレベル: 電子は異なるエネルギーレベルを占め、より低いレベルは核に近く、より高いレベルがさらに出ています。
* 軌道: 各エネルギーレベル内で、電子は軌道と呼ばれる空間の特定の領域を占有します。 これらの軌道は異なる形状(s、p、d、f)を持ち、特定の場所で電子を見つける確率を説明しています。
重要な概念:
* 原子番号: 要素を決定する原子の陽子の数。
* 質量数: 原子の陽子と中性子の総数。
* 同位体: 異なる数の中性子を持つ同じ元素の原子。
構造の視覚化:
核を、原子の中心にある小さな、密な、正に帯電した球体として想像してください。陽子や中性子よりもはるかに小さい電子は、雲のような領域の核の周りを常に移動します。
重要なポイント:
*原子体積の大部分は空のスペースです。
*核は、原子のサイズに比べて非常に小さいです。
*電子は絶えず動いているため、いつでも正確な位置を特定することは不可能です。 これが、確率領域(軌道)について話す理由です。
例:
炭素原子には、6つのプロトン、6つの中性子、および6つの電子があります。 6個のプロトンと6個の中性子が核内にあり、6個の電子は核の周りの軌道にあります。