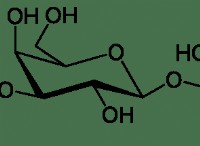
水中の物質の溶解度を考慮しています
水中の物質の溶解度は、いくつかの要因によって支配される複雑な現象です。
1。分子間力:
* "like like dislols like": この原理は、極性物質が極性溶媒に溶解し、非極性物質が非極性溶媒に溶解することを示しています。
* 極分子: 電子の不平等な共有のために永続的な双極子モーメントを持ち、部分的な正と負の電荷を引き起こします。水は非常に極性分子であり、他の極性分子との水素結合を形成します。
* 非極性分子: 電子密度の均一な分布を持ち、有意な電荷分離はありません。
* 水素結合: 高強性原子(酸素や窒素など)に結合した水素原子と隣接原子の電子ペアの間の強いタイプの分子間力。これは、水中の極性化合物の溶解度に重要な役割を果たします。
* 双極子型相互作用: 水素結合よりも弱いため、陽性と陰性の極の間の魅力のために極性分子間で発生します。
* ロンドン分散部隊: 電子分布の一時的な変動から生じるすべての分子に存在する最も弱いタイプの分子間力。
2。エントロピー:
* 障害の増加: 固体または液体を水に溶解すると、熱力学的に有利な障害(エントロピー)の増加につながることがよくあります。
* 絆の破壊と形成: 溶解するには、溶質を保持している結合を壊し、溶質と水分子の間に新しい結合を形成することが含まれます。このプロセスに関連するエンタルピー変化(ΔH)は、陽性(吸熱)または陰性(発熱)のいずれかです。
3。エンタルピー:
* 溶液のΔh: 水に物質を溶解することに関連する全体的なエンタルピー変化。これは、溶質結合を破壊し、溶媒溶媒結合を破壊し、溶質溶媒結合を形成するためのエンタルピー変化の合計です。
* 発熱溶解: 溶質溶媒相互作用の形成が元の結合を破るのに必要以上のエネルギーを放出する場合、溶解は発熱性です(ΔH<0)。
* 吸熱溶解: 新しい結合の形成で放出されるよりも多くのエネルギーが元の結合を破るために必要な場合、溶解は吸熱です(ΔH> 0)。
4。その他の要因:
* 温度: 温度の上昇は通常、固形物とガスの溶解度を高めますが、一部の塩の溶解度は低下します。
* 圧力: 液体へのガスの溶解度は、圧力に直接比例します(ヘンリーの法律)。
* 他の溶質の存在: 他の溶質を追加すると、特定の物質の溶解度に影響を与える可能性があります。
溶解度を決定する方法:
* 溶解度の予測: 「好きなような溶解」ルールに基づいて、関係する分子間力を理解する。
* 実験的決定: 特定の温度で特定の量の溶媒で溶解できる溶質の最大量を測定します。
例:
* 塩化ナトリウム(NaCl): 強い静電相互作用を伴う高極性イオン化合物。 水分子とNa+およびcl-イオン間の強い水分補給の相互作用のために、容易に水に溶解します。
* オイル: ロンドン分散力が弱い非極性物質。油分子と水分子の間の強い相互作用がないため、水に溶けません。
* 砂糖(C12H22O11): 水分子と水素結合を形成できる複数のヒドロキシル基を持つ極性分子は、水の溶解度が高くなります。
結論:
分子間力、エンタルピー、エントロピー、およびその他の要因の相互作用を理解することは、水中の物質の溶解度を予測して説明するために重要です。 これらの要因を考慮することにより、水溶液中のさまざまな物質の挙動に関する洞察を得ることができ、異なる化合物を溶解して分離するための効果的な戦略を設計できます。