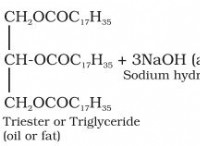1。溶解とイオン化:
*アルカリ金属は高度に電気依存症であり、液体アンモニアに溶解すると価電子電子を容易に失います。
*このイオン化により、アルカリ金属カチオン(Na+)と遊離電子が形成されます。
2。電子の溶媒和:
*解放された電子は、溶液中に自由のままではありません。代わりに、彼らはアンモニア分子に囲まれ、溶媒和電子を形成します 。
*アンモニア分子はリガンドとして作用し、自由電子と相互作用するために電子の唯一のペアを寄付します。
3。電子遷移と色:
*溶媒和電子は、電磁スペクトルの可視領域に特徴的な広範な吸収帯を持っています。
*この光の吸収は、基底状態から励起エネルギーレベルへの電子の移行によるものです。
*吸収バンドはオレンジの赤い領域に落ち、補完的な色につながります深い青 、送信されます。
要約:
液体アンモニア中の電子の溶媒和により、深い青色の色が生じます。この溶媒和プロセスは、電子がオレンジ色の赤色光を吸収できるユニークな環境を作成し、青色光の伝達をもたらします。
追加ポイント:
*青色は、アルカリ金属の濃度が増加するにつれて激化します。
*ソリューションは非常に反応性が高く、強力な還元剤です。
*溶媒和電子は、減少や重合など、さまざまな化学反応に重要な役割を果たします。