溶解度の理解
溶解度とは、物質(溶質)が別の物質(溶媒)に溶解して均一な混合物(溶液)を形成する能力を指します。 水は非常に一般的な溶媒です。
溶解度に影響する重要な要因
1。「「fike like」のような「原則:」
* 極対非極性: 水は極性分子です(正と負の端があります)。極性物質(砂糖、塩、多くのアルコールなど)は、水分子と一緒にアトラクションを形成できるため、水に溶ける可能性が高くなります。非極性物質(油や脂肪など)は、水への溶解性が低い傾向があります。
2。分子間力:
* 水素結合: 水は、他の水分子と強い水素結合を形成します。 水で水素結合を形成できる物質はより溶けやすい(例:エタノール)。
* 双極子型相互作用: 極性分子は双極子型双極子の相互作用を通して互いに引き付けられ、水に溶解する可能性が高くなります。
* ロンドン分散部隊: これらの弱い力はすべての分子に存在しますが、非極性物質ではより重要です。 強力なロンドン分散部隊を持つ物質は、水への溶解度が限られている可能性があります。
3。温度: 一般に、液体への固体の溶解度は、温度の上昇とともに増加します。 ただし、液体へのガスの溶解度は、温度の上昇とともに減少します。
4。圧力: 圧力は主にガスの溶解度に影響します。 より高い圧力は、液体中のガスの溶解度が高くなります。
より多くの可溶性を決定する方法
1。物質の性質を識別します:
*それらは極性ですか、それとも非極性ですか?
*水素結合を形成できますか?
*彼らは同様の分子間の力を持っていますか?
2。温度と圧力を考慮してください(該当する場合):
*より高い温度は一般に、固体の溶解度を高めます。
*より高い圧力は一般に、ガスの溶解度を高めます。
3。実験:
*不確かな場合は、簡単な実験を実行できます。等量の物質を水に溶解してみてください。より容易に溶解する物質はより溶けやすい。
例
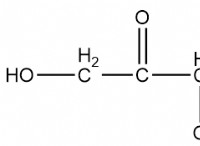
水中の砂糖(スクロース)と油(非極性)の溶解度を比較しましょう。
* 砂糖(スクロース): 極性、水素結合を形成し、容易に水に溶けます。
* オイル: 非極性は水素結合を形成しません、水に不溶です。
結論
砂糖は、極性であり、水分子と水素結合を形成できるため、油よりもはるかに溶けます。