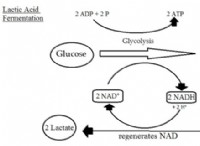
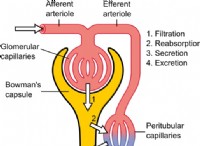
1。共有結合:
- 2つの原子間で電子の共有を伴います。
- これらの電子は両方の原子の核に引き付けられ、強い結合が生じます。
- 共有結合は、共有電子の数に応じて、単一、二重、またはトリプルにすることができます。
- 例:水(H₂O)には、酸素原子と各水素原子の間に2つの共有結合があります。
2。イオン結合:
- ある原子から別の原子への電子の伝達を伴います。
- この伝達は、正または負の電荷を持つ原子であるイオンを作成します。
- 反対に帯電したイオンは互いに引き付け、イオン結合を形成します。
- 例:テーブル塩(NaCl)は、ナトリウム(Na)から塩素(Cl)への電子の移動により形成され、正に帯電したナトリウムイオン(Na⁺)と負に帯電した塩化物イオン(Cl⁻)を作成します。
他のタイプの債券には次のものがあります。
- 金属結合: 電子が非局在化し、金属格子全体で自由に移動できる金属で見つかります。
- 水素結合: 高強性原子(酸素や窒素など)と別の電気陰性原子に共有結合した水素原子との間に発生する特別なタイプの弱い結合。
原子間で形成される特定のタイプの結合は、原子とそれらが持っている原子電子の数との電気陰性度の違いに依存します。