主な違い - 酸とアルカリ
酸とアルカリは、水生化学でよく使われる 2 つの用語です。酸は、酸性の特性を示す化学種です。アルカリは塩基の一種です。したがって、アルカリ溶液は基本的な性質を示します。酸とアルカリの主な違いは、 酸の pH は pH 7 未満ですが、アルカリ性の pH は pH 7 を超えています .
対象となる主な分野
1. 酸とは
– 定義、プロパティ、例
2. アルカリ性とは
– 定義、プロパティ、例
3. 酸とアルカリの違いは何ですか
– 主な違いの比較
重要な用語:酸、アルカリ、アルカリ土類金属、アルカリ、水生化学、塩基、ルイス酸、pH、強酸、弱酸 
酸とは
酸は、塩基によって中和できる化学種です。酸は、水溶液中でプロトンまたは H イオンを放出することができます。酸は、その共役塩基と H イオンに解離することができます。解離強度に応じて、2 種類の酸があります。
- 強酸
- 弱酸
強酸は、そのイオンに完全に解離できる化合物です。弱酸は、部分的にイオンに解離する化合物です。したがって、弱酸は、水溶液中の共役塩基および H イオンと平衡状態にあります。
酸の pH は常に 7 未満です。pH 7 は、純水などの溶液の中性 pH です。非常に低い pH 値は強酸によって与えられ、pH 7 に近い pH 値は弱酸によって与えられます。ただし、酸は水溶液に多量の H イオンを与え、pH は H 濃度の逆数の対数であるため、このように低い pH 値を持っています。
さらに、ドナーから電子対を受け取ることができる化合物は、ルイス酸として知られています。 .この定義によれば、H を含まない一部の化合物も酸に分類されます。たとえば、AlCl3 (三塩化アルミニウム)はルイス酸です。これは、Al 原子がドナーから入ってくる電子対を受け入れることができる空の p 軌道を持っているためです。
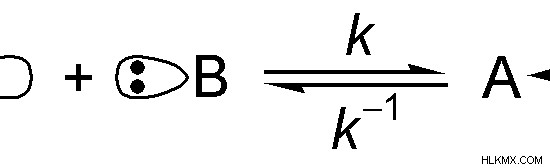
図 01:ルイス酸とルイス塩基の反応
上の画像で、「A」は化合物です。 「B」の孤立電子対を受け入れることができます。したがって、「A」はルイス酸です。
通常、酸は酸味があり、濃縮された形では腐食性があります。青色リトマスを赤色に変えることができます。ほとんどの酸は金属と反応し、塩と水素ガス (H2 ).
アルカリ性とは
アルカリ性は、pH 値が 7 を超える溶液です。これは、アルカリ性溶液が基本的な特性を示すことを意味します。したがって、アルカリ溶液は酸によって中和することができます。アルカリ溶液は苦味があり、触ると滑りやすくなります。
アルカリを水に溶かすと、アルカリ溶液が形成されます。アルカリは、塩基性水酸化物またはアルカリ金属またはアルカリ土類金属の塩を指す。アルカリという用語は、元素周期表の第 1 族と第 2 族の金属元素に由来します。 1族元素はアルカリ金属と呼ばれます。 2族金属はアルカリ土類金属と呼ばれます。どちらの種類の金属も、水に添加すると水の pH を上昇させます。それは、アルカリ金属やアルカリ土類金属を水に加えると、水分子と反応して金属水酸化物とH

図 02:アルカリ金属であるナトリウム (Na) と水 (H2O) の反応
それとは別に、アルカリ溶液は赤色リトマスを青色に変えることができます.これは、アルカリ溶液の塩基性を示しています。アルカリ溶液には腐食性のものとそうでないものがあります。すべてのアルカリ溶液は水に溶ける塩基です。しかし、一部の塩基は水に溶けないため、すべての塩基がアルカリ性というわけではありません.
アンモニア (NH3) もアルカリ金属の水酸化物や塩ではありませんが、アルカリ性に分類されます。これは、水に非常によく溶け、その水溶液が塩基性を示すためです。
酸とアルカリの違い
定義
酸: 酸は、pH 7 未満の化学種です。
アルカリ性: アルカリ溶液は、pH 7 を超える化学薬品です。
イオンあり
酸: 酸の水溶液は、H イオンで構成されています。
アルカリ性: アルカリ性の水溶液は、OH イオンで構成されています。
味
酸: 酸味は酸っぱいです。
アルカリ性: アルカリ性は苦い味です。
テクスチャ
酸: 酸は粘着性があります。
アルカリ性: アルカリ性は滑りやすいです。
中和
酸: 酸は塩基で中和できます。
アルカリ性: アルカリは酸で中和できます。
結論
酸とアルカリは、それぞれ低い pH 値と高い pH 値を持つ溶液です。酸とアルカリの主な違いは、酸のpHがpH 7未満であるのに対し、アルカリのpHはpH 7を超えることです。それらは水の酸性度とアルカリ度を決定する上で非常に重要な役割を果たします.したがって、それらは飲用やその他の目的で水質をチェックする際の貴重なパラメーターです。







