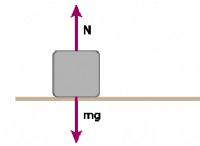
その理由は次のとおりです。
* 酸は、水に溶解したときに陽子を寄付する能力(H⁺)によって定義されます。 この陽子の寄付は、酸っぱい味や塩基との反応能力など、酸に特徴的な特性を酸に与えるものです。
* 水素イオンは、その電子を失った単なるプロトン(H⁺)です。 酸が水に溶けると、この水素イオンを溶液に放出します。
たとえば、
* 塩酸(HCl): HCl→H⁺ +Cl⁻
* 硝酸(hno₃): hno₃→h⁺ +no₃⁻
* 硫酸(h₂so₄): h₂so₄→2h⁺ +so₄²⁻
これらのすべての場合、酸が水に溶けると水素イオン(H⁺)が生成されます。