1。電子構成:
グループ内の要素は、同じ数の価電子を共有しています (最も外側のシェルの電子)。 これらの原子価電子は、化学結合に関与する電子です。
*電子構成のこの類似性は、同じグループの要素が同様の化学的挙動と反応性を持つ傾向があることを意味します。
2。反応性の傾向:
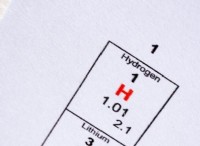
* アルカリ金属(グループ1): 高反応性金属は、+1イオンを形成するために容易に失われる1つの価電子しかないためです。 原子価電子が核から遠く、除去しやすいため、反応性はグループを下げます。
* アルカリアース金属(グループ2): 反応性金属ですが、アルカリ金属よりも反応性が低い。それらは2つの価電子を持ち、+2イオンを形成するために失う可能性があります。 反応性もグループを下げます。
* ハロゲン(グループ17): 7つの原子価電子があり、安定したオクテットを達成するためにもう1つだけ必要なため、高度反応性の非金属があります。 電子を獲得して-1イオンを形成します。添加された電子が核から遠く、魅力的ではないため、反応性はグループの下に低下します。
* nobleガス(グループ18): 非常に非アクティブで、不活性ガスと呼ばれることもあります。 彼らは電子の完全な外側の殻を持っており、非常に安定しています。
3。 その他の要因:
* イオン化エネルギー: 原子から電子を除去するために必要なエネルギー。電子を失うのにより少ないエネルギーが必要なため、イオン化エネルギーが低い要素はより反応的です。イオン化エネルギーは一般にグループを減少させます。
* 電気陰性度: 原子が電子を引き付ける傾向。 電気陰性度が低い元素は、電子を失う可能性が高く、より反応的です。一般に、電気陰性度はグループを減少させます。
例:
* ナトリウム(Na)とカリウム(K)はグループ1にあります。 どちらも、単一の価電子を容易に失い、+1イオンを形成する高度に反応性のある金属です。ただし、カリウムはナトリウムよりも反応性が高く、その原子価は核から遠く、除去しやすいためです。
結論:
定期的なテーブルのグループ組織は、要素がどのように振る舞い、反応するかを理解するためのフレームワークを提供します。グループ内の電子構成の類似性は、イオン化エネルギーや電気陰性度などの因子にさらに影響を与える予測可能な反応性パターンにつながります。