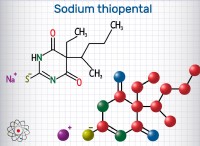
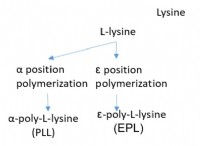
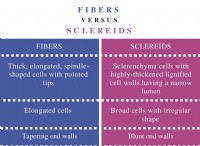
1。バランスの取れた化学式を書きます:
ch₄(g) +2o₂(g)→co₂(g) +2h₂o(g)
2。メタンの体積をモルに変換します:
*理想的なガス法:PV =NRTを使用します
* どこ:
* P =圧力=2.00 ATM
* v =ボリューム=12.50 l
* n =モル数(見つけたいもの)
* r =理想的なガス定数=0.0821l⋅atm/(mol⋅k)
* T =温度=202°C + 273.15 =475.15 K
* nを解決します:
* n =(pv) /(rt)=(2.00 atm * 12.50 l) /(0.0821lκ(mol⋅k) * 475.15 k)
*n≈0.643molch₄
3。生成された蒸気のほくろを決定します:
*バランスの取れた方程式から、1モルのCh₄は2モルのH₂Oを生成します。
*したがって、0.643 molch₄は次のことを生成します:0.643 molch₄ *(2 molh₂o / 1 molch₄)=1.29 molh₂o
回答: 約 1.29モル 蒸気が生成されます。