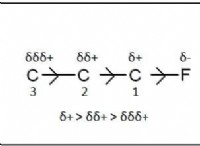
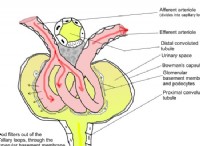
アンモニア(NH3):
* 反応: NH3(AQ) + H2O(L)⇌NH4 +(aq) + oh-(aq)
* 平衡: この反応は、アンモニウムイオン(NH4+)と水酸化物イオン(OH-)を形成し、アンモニア(NH3)および水(H2O)との平衡を確立します。
硫化水素(H2S)の場合:
* 反応: H2S(AQ) + H2O(L)⇌HS-(AQ) + H3O +(AQ)
* 平衡: この反応は、硫化水素イオン(HS-)およびヒドロニウムイオン(H3O+)を形成し、硫化水素(H2S)と水(H2O)との平衡を確立します。
重要なメモ:
* nh3は弱い塩基です: それは水と反応して少量のオハイオンを生成し、溶液をわずかに基本的にします。
* H2Sは弱酸です: 水と反応して少量のH3O+イオンを生成し、溶液をわずかに酸性にします。
* 平衡の位置: これらの反応の平衡位置は、反応物と生成物の初期濃度、ならびに温度と圧力に依存します。
* 他のイオンの存在: 溶液中の他のイオンの存在は、平衡位置にも影響を与える可能性があります。
これらの反応は、水に溶解すると、NH3およびH2がそれぞれ弱い塩基と弱酸として作用する能力を示しています。