pH はポテンシャル水素を表し、「p」はポテンシャルを意味し、「H」は水素を表します。 pH スケール 物質中の水素イオン活性の量に基づいて、物質の相対的な塩基性または酸性度を他の物質と比較してランク付けするために使用される尺度です。
スケールは本質的に対数であり、すべての全 pH 値が前の値の 10 倍の変化を表すことを意味します。 pH スケール 中性であり、酸でも塩基でもない物質を表す pH 7 付近に基づいています。
pH スケールの基礎
酸と塩基の概念に精通していなくても、それらに触れることは確かにあります。塩基性物質は重曹のようなもので、酸性物質はオレンジ ジュースやソーダのようなものです。物質は、その物質が持つ水素イオンの濃度に基づいて、塩基または酸に分類されます。 pH の H は、特定の溶液中の水素イオン活性のレベルを表します。したがって、このように酸性溶液と塩基性溶液を定義することが可能です:
酸性溶液は、水素イオンのレベルが純水に見られる量よりも多い溶液です (これは中性 7 にあります)。対照的に、塩基性溶液の水素イオン濃度は水よりも低くなります。

純水はpHスケールの中性点として機能するので、水の性質を見て、それを水素イオンの文脈に置きましょう.水のイオン化とは、一定量の水に含まれる水分子のわずかな割合が、解離または小さな粒子に分裂する際に、水素イオンを自発的に生成する方法を指します。これは、自動イオン化と呼ばれることもあります。自動イオン化のプロセスでは、同数の水酸化物 (OH-) イオンと水素 (H+) イオンが生成されます。水素イオンは通常、近くの水分子と直接結合してヒドロニウム (H3O+) を形成することに注意してください。これは、実際には水の中にたくさんの水素イオンが浮遊していないことを意味します。しかし、科学者は、他の溶液中の水素のレベルを比較できるスケールを作成する方法として、水のイオン化とそれらが生成する水素イオンを依然として使用しています。通常、水酸化物イオンは、水素イオンとは異なり、溶液内を浮遊します。
自己イオン化によって生成される水素イオンの数に換算すると、その量は 1 x 10^-7 M (純水と仮定) に相当します。表記は、水 1 リットルあたりのモル数を表します。イオン化された水分子の数は、任意の量の純粋な水に見られる水分子の総数の信じられないほど小さい割合です.
酸性溶液と基本溶液
溶液の塩基性と酸性度の基準点を確立したので、酸と塩基がどのように定義されるかについて説明します。酸性溶液は、純水よりも H+ 濃度が高い溶液であり、塩基性溶液は、純水よりも H+ 濃度が低い溶液です。別の言い方をすれば:
ベース =H+ 濃度 <1 x 10^-7 M
酸 =H+ 濃度> 1 x 10^-7 M
溶液中の水素イオンの濃度は、通常、pH で与えられ、その溶液の水素イオン濃度の逆対数として計算されます。
pH =-log10[H+]
したがって、水の水素イオン濃度をこの式に入れると、7.0 の値、または pH スケールの中性 pH が得られます。ご想像のとおり、細胞内のサイトゾルや人体の血液など、主に水でできている物質は、中性 7 に非常に近い pH 値を持っています。酸と塩基を水ベースの溶液に加えて、その溶液の濃度を中性 pH ポイントから遠ざけることができます。塩基は通常、水酸化物を環境に導入することで pH レベルを上昇させ、水素イオンを集めて溶液から引き抜きます。一方、酸性物質は、その水素原子の1つを解離して溶液に導入することにより、水素イオン濃度を増加させるものです.
酸が強力であるほど、分解が速くなり、H + が放出されます。強酸の例としては HCl があり、これは水と結合すると、塩化物イオンと水素イオンに迅速かつ完全に解離します。対照的に、酢のような弱酸は完全には解離しません。強塩基性物質は、水中で H+ を吸収できる水酸化物イオンを放出し、強酸性物質と同じように完全に分解します。強塩基の例は水酸化ナトリウムです。
pHスケールの強さ
前述のように、pH スケールは、塩基性度 (アルカリ度とも呼ばれる) と酸性度の観点からさまざまな化学組成をランク付けするのに役立ちます。対数的性質とは、発生する 1 pH 単位の増加ごとに、H+ の濃度が 10 倍増加することを意味します。 0 ~ 14 の pH 範囲外にある物質もいくつかありますが、ほとんどの溶液はこの範囲内にあるため、通常、pH スケールは 0 ~ 14 で表され、塩基性物質は 7 を超える任意の値、酸性物質は任意の値です。ニュートラル 7 未満の値。
極度に塩基性または極度に酸性の物質のいずれかの pH スケールの遠端にある物質は、有機物質に非常に有害であり、細胞に重大な損傷を与えます。強塩基性物質と強酸性物質の両方が本質的に腐食性であり、人の組織に損傷を与える可能性があります.溶液のpH、および暴露される溶液の量と暴露時間はすべて、物質がどれだけの損傷を与えるかを決定する要因です.胃酸、つまり胃酸が強酸性物質であることにお気づきかもしれません。あなたの体はどのようにしてこの酸から身を守っていますか?胃酸と体内の他の細胞との間のバリアとして機能するように特別に作成された特定の胃細胞があり、それらは常に作成され犠牲にされています.
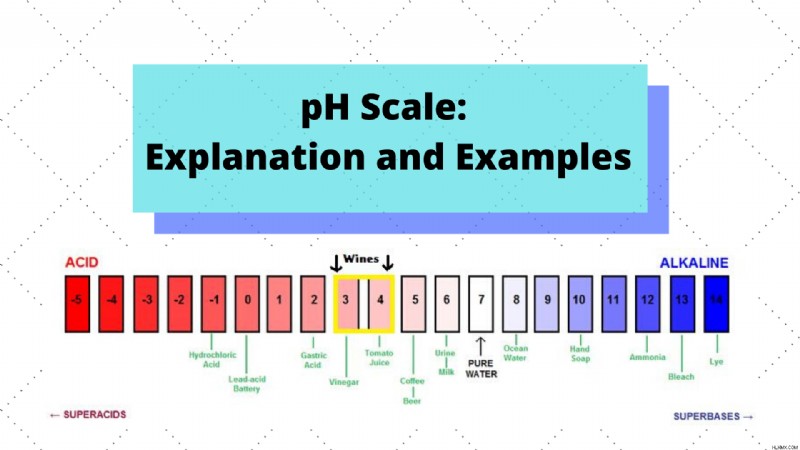
例
一般的な溶液とその pH 値の例:
<オール>






