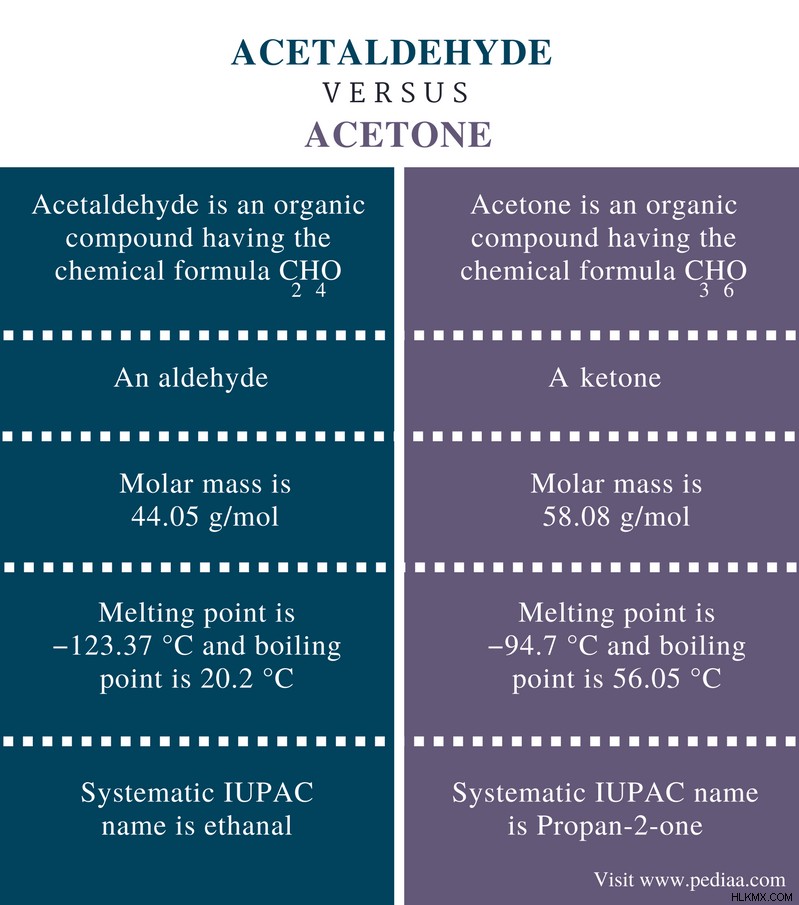
主な違い - アセトアルデヒドとアセトン
アセトアルデヒドとアセトンは、炭素原子と 1 つの酸素原子といくつかの水素原子で構成される有機化合物です。しかし、それらは異なる官能基を持っているため、異なる化学的および物理的特性を持っています.官能基は原子の一部であり、分子の特性を決定する原子のグループです。アセトアルデヒドとアセトンはどちらも、室温と圧力で液体化合物です。アセトアルデヒドとアセトンの主な違いは、アセトアルデヒドはアルデヒドであるのに対し、アセトンはケトンであることです。
対象となる主な分野
1.アセトアルデヒドとは
– 定義、化学的性質、用途
2.アセトンとは
– 定義、化学的性質
3.アセトアルデヒドとアセトンの違いは何ですか
– 主な相違点の比較
キーワード:アセトアルデヒド、アセトン、アルデヒド、官能基、ケトン
アセトアルデヒドとは
アセトアルデヒドは、化学式 C2 を持つ有機化合物です。 H4 O. この化合物は、室温および圧力で無色の液体として存在します。アルデヒド基(-CHO)から構成されるアルデヒドです。アセトアルデヒドのモル質量は 44.05 g/mol です。
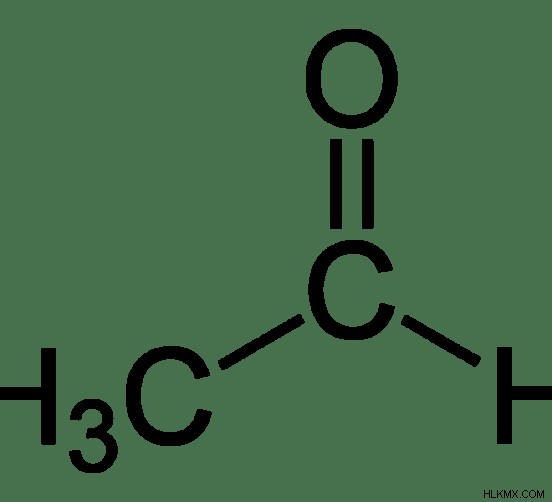
図 1:アセトアルデヒドの化学構造
アルデヒド基にメチル基が結合した単純なアルデヒド分子です。アセトアルデヒドの融点は-123.37°C、沸点は20.2°Cです。アセトアルデヒドの体系的な IUPAC 名は エタナール です .アセトアルデヒドは、1-ブタノール、酢酸エチルなどの化合物の製造に使用されます。また、香水、合成ゴム、香料などの製造にも使用されます。純粋なアセトアルデヒドは、無色で可燃性の液体です。
アセトアルデヒド生成の主要なプロセスは、ワッカー プロセスと呼ばれます .これには、エチレンのアセトアルデヒドへの酸化の触媒作用が含まれます。触媒は、塩化パラジウムと塩化銅の 2 つの成分の混合物です。
アセトアルデヒドは、縮合反応、互変異性化などのいくつかの重要な化学反応を起こします。ただし、ヒトに対する発がん性化合物として認識されています。長期間さらされると有毒です。皮膚や目に刺激を与えます。
アセトンとは
アセトンは、化学式 C3 を持つ有機化合物です。 H6 O. この化合物のモル質量は 58.08 g/mol です。ケトンです。室温および圧力では、無色、揮発性、可燃性の液体です。ケトン化合物の中で最も単純なケトンです。刺激臭があります。

図 2:アセトンの化学構造
アセトンの IUPAC 名は Propan-2-one です .融点は-94.7°C、沸点は56.05°Cです。水と混和します。アセトンは、プロピレンから直接または間接的に製造できます。現代の方法はクメンプロセスです。ここでは、ベンゼンがプロピレンでアルキル化され、化合物クメンが生成されます。次に、このクメンは空気によって酸化されます。これにより、フェノールとアセトンが得られます。したがって、フェノールとともにアセトンが生成されます。
アセトンは主に溶剤として使用されます。防腐剤としても使用されます。動物性脂肪代謝の産物として、植物、自動車の排気ガスに含まれています。アセトンは水よりも密度が低く、アセトン蒸気は通常の空気より重い.
アセトアルデヒドとアセトンの違い
定義
アセトアルデヒド: アセトアルデヒドは、化学式 C2 を持つ有機化合物です。 H4 O.
アセトン: アセトンは、化学式 C3 を持つ有機化合物です。 H6 O.
カテゴリ
アセトアルデヒド: アセトアルデヒドはアルデヒドです。
アセトン: アセトンはケトンです。
化学式
アセトアルデヒド: アセトアルデヒドの化学式はC2 H4 O.
アセトン: アセトンの化学式はC3 H6 O.
モル質量
アセトアルデヒド: アセトアルデヒドのモル質量は 44.05 g/mol です。
アセトン: アセトンのモル質量は 58.08 g/mol です。
融点と沸点
アセトアルデヒド: アセトアルデヒドの融点は-123.37°C、沸点は 20.2°C です。
アセトン: アセトンの融点は-94.7°C、沸点は56.05°Cです。
IUPAC名
アセトアルデヒド: アセトアルデヒドの体系的な IUPAC 名はエタナールです。
アセトン: アセトアルデヒドの体系的な IUPAC 名はプロパン-2-オンです。
結論
アセトアルデヒドとアセトンは有機化合物です。アセトアルデヒドもアセトンも無色の液体化合物です。アセトアルデヒドとアセトンの主な違いは、アセトアルデヒドはアルデヒドであるのに対し、アセトンはケトンであることです.







