スイカやレーズンプリン、梅プリンなどは日常生活で一度は目にしたことがあると思います。トムソン原子モデルと呼ばれる初期の原子モデルの 1 つは、これらの食品の外観と比較されています。この記事は、このトムソン原子モデルについて詳しく説明することを目的としています。
歴史
亜原子粒子が発見される前に、ダルトンの原子理論はジョン・ダルトンによって与えられました。この理論では、彼は原子を分割不可能な粒子と表現しました。つまり、原子はさらに小さな粒子に分解することはできません。後に、ダルトン原子理論で提案された仮説は、JJ トムソンが素粒子を発見したため、承認されませんでした。
JJ トムソンが亜原子粒子を発見したことで、これらが原子内でどのように配置されているかの調査が始まりました。原子構造のモデルを提案した多くの科学者の中で、J.J.トムソンは初めてでした。 1897年、彼は陰極線管実験と呼ばれる実験を通じて負に帯電した粒子を発見しました。これらの粒子に「電子」という名前が付けられました。 J. J. によると、トムソン博士によると、電子は陽子の 2,000 分の 1 の軽さです。彼はまた、原子は正電荷の球体に負電荷を帯びた粒子の雲で構成されていると信じていました。ラザフォードとJ.J.トムソンは、空気が X 線でどのようにイオン化されるかを最初に示しました。
トムソンの原子モデル
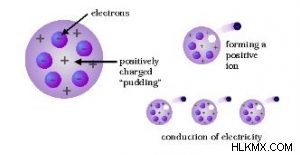
原子の多くの科学的モデルの中で、トムソン原子モデルは、外観をスイカと比較できるモデルです。これは、スイカの赤い可食部に黒い種子が分散しているように、電子が原子内の正に帯電した球体に分散していることを示唆しているためです。このモデルは、1903 年に J.J.電子を発見した後のトムソン。当時、原子核はまだ発見されていませんでした。そのため、彼は当時知られていた原子の性質に基づいたモデルを提案しました。それらは次のとおりです。
- 原子は中性の電荷を持っています。内部の 2 種類の電荷が互いに釣り合っているため、正にも負にも帯電していません。
- 原子は、電子として知られる負に帯電した粒子で構成されています。
トムソンの原子モデルの仮定
トムソンの原子モデルのこれらの仮定によると、原子は、電子と呼ばれる負に帯電した粒子を含む正電荷の球体のように見えます。負に帯電した粒子と正の電荷の大きさが等しいため、それらは互いにバランスを取り、したがって、原子は全体として電気的に中性であり、電荷を帯びていません。
トムソンが提案した原子モデルは、スイカや球状のプラム プディングのように見えます。これは、このモデルでは、電子が正電荷の球体に埋め込まれたレーズンのように見えるためです。ちょうどプラム プディングが見えるからです。また、果物の赤い食用部分は正に帯電した球体と比較できるため、スイカのようにも見えますが、果物に分散した黒い種子は球体の電子に似ています.

トムソンの原子モデルに取り組む
J.J. によって一連の実験が行われました。陰極線の性質を観察するトムソン。その目的は、陰極線が負に帯電していると結論付けることでした。彼が設計した装置は陰極線管として知られていました。現在では「電子銃」とも呼ばれています。
電子は、管の左側にあるカソードから、アノードを経由して右側のリン光スクリーンに移動します。彼は、磁場をオフにすると、電場がビームを偏向させる可能性があることを観察しました。彼はまた、磁場と電場の強さを調整すると、陰極線に偏向が見られないことにも気付きました。
圧力が低い場合 (水銀柱 1 mm 程度)、陰極線は暗く見え、陰極の近くでわずかに発散します。この暗い空間の広がりは、ぼやけて見えるまでチューブを通して発生します。ガラスに到達するか、蓄光スクリーンに触れると、陰極線がエネルギーを吸収するため、光って見えます。彼は、装置の長さ、たわみ、および電荷対質量比を計算するための磁場と電場の強さを測定しました。彼は、この比率がチューブ内の金属とガスに依存していないことを観察しました。これにより、彼は負に帯電した粒子が原子粒子であるという結論に達しました。
彼は、荷電粒子の動きに垂直な方向に強度 B の均一な磁場を適用すると、それらが円形の経路で偏向することに気付きました。この円軌道の半径 R は、磁場「qvB」を求心加速度の質量倍に等しく保つことで取得できます。その後の実験で、トムソンは陰極線ビームが偏向しないように磁場と電場を変更しました。むしろ、それはまっすぐです。磁力と電気力を等しくすることで、速度 v を求めることができました。
梅プリンモデルの応用
- J.J. による陰極線実験。トムソンは現代のエレクトロニクスに道を譲り、ダイオードとトランジスタの発見の基礎を形成しました。研究者は実験から、陰極線は直線的に伝搬し、波の特性を研究するのに役立ったと結論付けました。
- 最近の電子機器では、ブラウン管が広く使用されています。
- J.J. が行った実験。トムソンは、現代の量子物理学に革命をもたらしました。
トムソンの原子モデルの限界
- 彼の原子モデルは、原子内で正電荷が負電荷を帯びた電子を保持する方法を説明できませんでした。原子の安定性を説明しています。その結果、この仮説は原子核の位置を説明できませんでした。
- トムソンのモデルでは、薄い金属箔がどのようにアルファ粒子を散乱させるかを説明できませんでした。
- 反対の実験的証拠はありません。
トムソンのモデルは原子構造を正確に表していませんでしたが、さまざまな原子モデルを作成するための基礎となりました。ここで原子構造のpdfを見つけてください。人類の進歩に大きく貢献した数多くの技術は、原子とその構造の研究によって可能になりました。
その他のアトミック モデル
ラザフォードの原子モデル
プラム プディング モデルでは原子構造の特定の側面を説明できなかったため、アーネスト ラザフォードという英国の科学者が実験を行いました。この実験で彼が行った観察に基づいて、彼は独自の原子モデルを与えました。彼によると、正電荷と原子質量のほとんどは、核と呼ばれる小さな体積に詰め込まれています。彼はまた、電子が原子核を取り囲み、円軌道を描いて周回していることを提案しました。原子核は高密度に濃縮された正電荷の塊であると考えられており、その周りを回転する電子は負に帯電しているため、静電力と呼ばれる強力な引力によって結合されています。
ボーアの原子モデル
Neil Bohr は、1915 年にラザフォードの原子モデルを修正した原子モデルを発表しました。上記で説明したように、ラザフォードは、原子には正電荷が集中している原子核が含まれており、軌道と呼ばれる円形の経路でその周りを回転する負電荷の電子に囲まれていることを示唆しました。ボーアはこれらの軌道を軌道殻と呼び、各軌道が固定量のエネルギーを持ち、その異なるレベルが量子数と呼ばれる 1、2、3 などで表されることを示唆しました。番号付けは核から始まり、n=1 が最低エネルギー準位と見なされます。その後の軌道殻は、K、L、M… と指定されます。 n=1,2,3…..の場合も同様です。電子は、そのエネルギー レベルが最も低いときに基底状態にあると見なされます。
原子内では、電子は一定量のエネルギーを獲得し、より低いエネルギー準位からより高いエネルギー準位に移動します。エネルギーが失われると、電子はより高いエネルギー レベルからより低いエネルギー レベルに移動します。
結論
原子モデルのJJトムソンの発見は、今日では有効ではなく、制限がありますが、後に明るみに出た他の多くの原子構造モデルへの道を開きました.これは、その後の実質的な革新的発明に道を譲る基礎モデルとして機能しました.
よくある質問
1.原子モデルのトムソンの発見が破棄されたのはなぜですか?
A) トムソンの原子モデルは、原子の安定性を説明できませんでした。また、トムソンは、電子がスイカに種子が分散する方法やプリンにレーズンが分散する方法と同様の方法で原子内に分布していることを示唆しました。正に帯電した球の内部に低い電子が保持されていることを説明できませんでした。したがって、破棄されました。
2.原子モデルのトムソン発見の重要な特徴を挙げてください。
A) トムソンによる原子モデルの発見には、次のような特徴がありました:
- 原子は、電子が分散している正電荷の球体で構成されています。
- 原子内の正と負の量は等しいため、電気的に中性です。
3.トムソンのモデルはどの果物と比較されますか?
A) Thomson によって与えられた原子モデルは、赤い食用部分が正に帯電した球のように見えるスイカと比較されますが、黒い種子はその中に分散し、球内の電子と比較されます。
4.トムソンの原子モデルで説明されなかったものは何ですか?
A) トムソンの原子モデルは、原子の安定性を説明しませんでした。また、陽子と中性子、中性子、原子核についても言及していません。