エタンホウ素、水素化ホウ素、および六水素化ホウ素の名前でも知られるジボランは、化学的には B2H6 と表されます。ジボランは、ホウ素化合物のファミリーの主要なメンバーです。ジボランのモル質量は 27.66 グラム/モルで、これはジボラン (B2H6) に存在するすべての構成元素の合計です。
ジボランでの結合
名前が示すように、ジボランは 2 つのホウ素原子の化合物であり、これらの 2 つのホウ素原子とともに 6 つの水素原子も存在します。ホウ素の原子番号は 5 で、その電子配置は 1s2、2s22p1 と書かれていることがわかっているので、配置から、ホウ素の最外殻には 3 つの価電子が存在することがわかります。これらの 3 つの価電子は、水素との結合の形成に関与します。
各ホウ素原子の 3 つの価電子のうち、共有結合の形成の結果として電子を共有することにより、2 つの電子が 2 つの水素原子と結合します。このタイプの結合は、2 中心 - 2 電子結合として知られています。この共有結合の形成は、分子軌道理論によって正当化されます。 2 つの水素原子は、分子の末端に存在するため、末端水素と呼ばれます。
ホウ素の残りの 1 つの電子は、3 つの中心がホウ素 - 水素 - ホウ素である 3 つの中心 - 2 つの電子結合として、1 つの水素とブリッジ結合を作ります。この結合には、2つの電子が関与しています。この架橋結合はバナナ結合とも呼ばれ、その構造はバナナのように曲がっており、この結合の性質はイオン性を示します。
ジボランの構造における末端の水素とホウ素原子の間の結合の長さは 1.19 Å です。ジボランの構造における架橋水素とホウ素原子の間の結合の長さは 1.33 Å です。末端のホウ素の水素結合の長さは、ブリッジのホウ素の水素結合よりも短いため、より大きな強度を示します。
赤外線スペクトルの周波数の値は、架橋ホウ素水素結合よりも多くなっています。より強い結合はより多くのエネルギーで振動し、高い振動周波数を示します。したがって、末端のホウ素水素の頻度は、架橋ホウ素の水素結合よりも多くなければなりません。ブリッジのホウ素-水素結合と末端のホウ素-水素結合の振動数の値は、それぞれ 2100 と 2500 cm−1 です。
ジボランの構造
ジボランの結合に関する上記の説明から、ジボランの構造は次のように示されます。 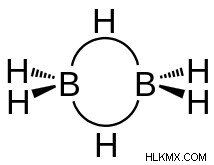
ジボランの構造では、各ホウ素原子は sp3 混成で存在します。これは、ホウ素原子が結合の形成に関与する 4 つの混成軌道を持っていることを意味します。これらの 4 つの混成軌道のうち、結合を作るために電子を運ぶことができる軌道は 3 つだけです。 2 つの混成軌道はホウ素-水素結合を形成し、1 つの混成軌道はホウ素-水素架橋結合を形成します。これらの 4 つの混成軌道のうち、混成軌道の 1 つが空いたままであり、架橋水素との別のバナナ結合の形成に関与します。
ジボランの構造は、4 つの末端水素と 2 つのホウ素原子が 1 つの平面に存在し、架橋水素がその平面の上下に垂直な平面に存在するため、非平面です。これらのジボラン分子は、D2h 点群対称性のカテゴリに分類されます。これは、ジボランの構造が恒等操作、対称中心を通る反転、およびホウ素原子と水素原子の間の 3 つのシグマ結合に沿った 3 つの C2 回転軸で構成されることを意味します。
結論
ジボラン分子は、4 つの末端の通常の B–H 共有結合に加えて、ブリッジ結合として 2 つの B–H–B バナナ結合で構成されているため、化学における他の有機分子と比較して、ジボランの構造は多少異なります。債券。ジボランの構造は、架橋水素が別の平面の上下に存在するため、非平面です。







