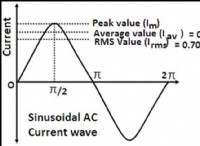
概念を理解する
* 理想的なガス法: 理想的なガス法は、理想的なガスの圧力(p)、体積(v)、温度(t)、およびモル数(n)の数との関係を説明しています:pv =nrt。
* 一定のボリューム: 容器は硬いため、ボリューム(v)は一定のままです。
* 直接比例: 理想的なガス法は、体積(v)とモル(n)が一定の場合、圧力(p)が温度(t)に直接比例することを示しています。
計算
1。温度をケルビンに変換:
* 2°C + 273.15 =275.15 K
* 10°C + 273.15 =283.15 K
2。割合を設定:
ボリュームとモルは一定であるため、次のことを書くことができます。
p₁/t₁=p₂/t₂
どこ:
*p₁=初期圧(3.0 atm)
*t₁=初期温度(275.15 k)
*P₂=最終圧力(不明)
*t₂=最終温度(283.15 k)
3。p₂:を解決します
*p₂=(p₁ *t₂) /t₁
*p₂=(3.0 atm * 283.15 k) / 275.15 k
*p₂≈3.09atm
答え
容器内の圧力は、約 3.09大気に増加します 温度が摂氏10度に上昇した場合。