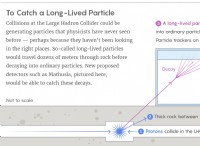
1。ファンデルワールス力: これらは、分子の周りの電子分布の一時的な変動から生じる弱い短距離の力です。 3つのタイプがあります。
* ロンドン分散部隊: すべての分子、非極性の分子にも存在します。それらは、変動する電子雲によって誘導される一時的な双極子のために発生します。
* 双極子型力: 永久双極子を持つ極地分子間(正電荷と負の電荷の分離)が発生します。
* 水素結合: 水素原子が酸素、窒素、またはフッ素のような高電気陰性原子に結合したときに発生する特別なタイプの双極子双極子相互作用。これにより、水素原子と別の電気陰性原子に孤立した電子の間に強い引力が生じます。
2。イオン双極子力: これらは、イオンが極分子と相互作用するときに発生します。たとえば、積極的に帯電したイオンは極地分子の負の端に引き付けられ、負に帯電したイオンは正の端に引き付けられます。
3。金属結合: これは、金属で発生する特別なタイプの結合です。これには、すべての金属原子間で非局在電子の共有が含まれます。これらの共有電子は、金属原子を一緒に保持する強力な引力を作り出します。
これらの力の相対強度は、液体の特性を決定します:
* 分子間力より強い: 沸点が高く、粘度が高く、表面張力が大きくなります。
* 分子間力が弱い: 沸点が低く、粘度が低く、表面張力が弱くなります。
次のことに注意することが重要です:
*液体は通常、これらの分子間力の組み合わせを経験します。
*これらの力の相対強度は、関連する特定の分子によって異なります。
*分子間力は、液体の粘着性(分子間の引力)の原因となりますが、液体分子と他の物質(ガスや固体など)との相互作用にも影響し、粘着性が生じます。
これらの概念のいずれかをより深く掘り下げたい場合はお知らせください!