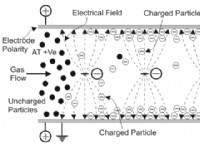
共有半径の傾向
* グループ(列)の増加: グループを下ると、電子シェルの数が増加します。これは、最も外側の電子が核からさらに遠く、より大きな共有半径につながることを意味します。
* 期間(行)で減少します: 期間を移動すると、核内の陽子の数が増加します。これにより、核と電子の間のより強い魅力につながり、それらを近づけ、より小さな共有半径になります。 また、期間を移動する際に、有効な核電荷(最も外側の電子が経験する正味の正電荷)の増加もあります。
共有半径に影響する重要な要因
* 電子シェルの数: シェルが多いと、より大きな原子が意味があります。
* 効果的な核電荷: より高い効果的な核電荷は、電子を核に近づけ、原子を小さくします。
* シールド効果: 内側の電子は、完全な核電荷から外側の電子を保護し、最も外側の電子への影響を減らします。 このシールド効果は、内側の電子の数が増えているため、グループを増加させます。
例
* グループ1(アルカリ金属): リチウム(LI)は最小の共有半径を持ち、セシウム(CS)は最大です。これは、CSがLiよりも多くの電子シェルを持っているためです。
* 期間2: ホウ素(B)は、フッ素(F)よりも大きな共有結合半径を持っています。これは、Fの効果的な核電荷が高いためであり、その電子を核に近づけます。
重要な注意: これらの傾向には、特に遷移金属と部分的に満たされたdまたはf軌道を持つ要素を扱う場合は、いくつかの例外があります。これらの例外は、電子構成や電子間反発などの要因によるものです。
これらの概念のいずれかについてもっと詳細をご希望の場合はお知らせください!