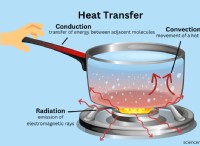
* エネルギーレベル: 図は、水平線を使用して異なるエネルギーレベルを表します。より高い線は、より高いエネルギーレベルを示しています。
* 電子占有: 各ラインは、原子構造の量子ルールによって決定される特定の数の電子で満たすことができます。
* 基底状態: 最低のエネルギーレベルは基底状態と呼ばれます。電子は通常、エネルギーを獲得しない限りここに住んでいます。
* 励起状態: 電子がエネルギーを吸収すると、励起状態と呼ばれるより高いエネルギーレベルにジャンプできます。
* 遷移: この図は、光子(光)を吸収または放出することにより、電子がエネルギーレベル間にどのように移行できるかを示しています。
電子エネルギーレベル図の重要な特徴:
* 離散エネルギーレベル: 電子は、特定の個別のエネルギーレベルでのみ存在し、その間ではありません。
* エネルギーの量子化: エネルギーは量子化されています。つまり、Quantaと呼ばれるパケットに含まれています。これが、電子が特定のレベル間でジャンプする理由です。
* 各原子に対して一意: 各原子には、その原子構造に応じて、独自のエネルギーレベルの独自のセットがあります。
電子エネルギーレベル図の使用:
* 原子スペクトルの説明: この図は、電子がエネルギーレベル間に移動すると、原子によって放出または吸収される特徴的なスペクトル線を説明するのに役立ちます。
* 化学的結合の理解: エネルギーレベルの電子の配置は、原子がどのように相互作用し、化学結合を形成するかを決定します。
* 反応性の予測: これらの電子は簡単に励起され、化学プロセスに関与する可能性があるため、より高いエネルギーレベルの電子を持つ原子は反応する可能性が高くなります。
電子エネルギーレベルの特定の側面の詳細な説明や図の読み方をお知らせください。