* 分子間力: これらは、ガス分子間の引力または反発の弱い力です。それらは、原子を分子で一緒に保持する力よりもはるかに弱いです。
* van der Waals Force: これらは、ガス中の分子間力の主なタイプです。それらは、分子の周りの電子分布の一時的な変動から生じ、互いに引き付けたり撃退したりできる一時的な双極子につながります。
* 水素結合: これは、水素原子が高電気陰性の原子(酸素、窒素、またはフッ素など)に結合したときに発生する特別なタイプの分子間力です。それは典型的なファン・デル・ワールスの力よりも強い魅力です。
* 運動エネルギー: これが運動のエネルギーです。 ガス分子は常にランダムな動きであり、その運動エネルギーは温度に直接比例します。この動きは、ガス分子間の衝突を引き起こし、ガス圧の基礎となります。
これらの力とガス分子の運動エネルギーは、以下を含むガスの重要な特性を決定します。
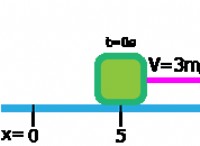
* 圧力: ガスの圧力は、容器の壁との分子の衝突によって引き起こされます。
* 温度: ガス分子の平均運動エネルギーは、その温度に直接比例します。
* ボリューム: ガスの容積は、それが占める空間によって決定されます。
* 拡散: ガス分子はランダムに移動し、容器を満たすために広がります。
ガス分子は固体や液体に比べて非常に離れていることに注意することが重要です。これは、分子間の力がガスではるかに弱いことを意味し、分子は動き回る自由がより自由にあることを意味します。