主な違い – アウフバウの法則とフントの法則
原子構造の開発は、ダルトンの現代原子理論から始まりました。すべての物質は原子でできており、原子をさらに小さな粒子に分割することはできないと述べました。しかし、後に J.J.トンプソン、ラザフォードによる原子核の発見、ニールス ボーアの電子軌道の概念。現在受け入れられている原子の構造には、電子殻、副殻、および軌道に関する詳細が含まれています。電子がこれらの殻と軌道に入る方法は、アウフバウの原理とフントの法則を使用して説明できます。アウフバウの法則とフントの法則の主な違いは、アウフバウの法則はサブシェルが電子で満たされる順序を示すのに対し、フントの法則はサブシェルの軌道が電子で満たされる順序を示すことです。
対象となる主な分野
1.アウフバウ原理とは
– 理論、例による説明
2.フントの法則とは
– 理論、例による説明
3.アウフバウの原理とフントの法則の類似点は何ですか
– 共通機能の概要
4.アウフバウの原理とフントの法則の違いは何ですか
– 主な違いの比較
重要な用語:原子、アウフバウの原理、電子、フントの法則、軌道 
Aufbau Principleとは
アウフバウの原理では、電子が原子のサブシェルに充填される順序は、最低エネルギー準位から最高エネルギー準位の順であると述べられています。言い換えれば、電子が原子の軌道に満たされるとき、電子は、高エネルギー準位を満たす前に、最初に最も低いエネルギー準位にある軌道を満たします。
一般的に、殻準位では 1 <2 <3 <4、軌道準位では s
予想される注文
1s <2s <3s <3p <3d <4s <4p <4d <5s…
実際の注文
1秒 <2秒 <3秒 <3p <4秒 <3d <4p <5s <4日…
しかし、各軌道のエネルギー準位を一つ一つ覚えるのは難しいです。したがって、次の図を使用して、エネルギー レベルを簡単に決定できます。
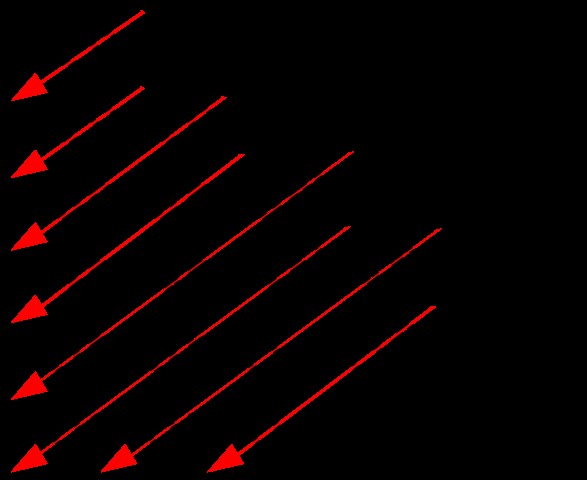
図 1:軌道のエネルギー レベルの順序
上の画像は、エネルギー レベルを決定するための図を示しています。ここで、矢印の経路をたどることで軌道の順序を取得できます。各矢印の頭の後、次の矢印から始めます。このようにして、エネルギー レベルを簡単に取得できます。
フンドの法則とは
フントの法則は、電子がサブシェルの軌道に入る順序を説明しています。サブシェルは軌道で構成されています。 1 つのサブシェルに存在する軌道の数は、サブシェルごとに異なります。たとえば、s サブシェルには 1 つの s 軌道しかなく、p サブシェルには 3 つの p 軌道があり、d サブシェルには 5 つの d 軌道があります。したがって、これらの軌道を電子で満たす順序があるはずです。そうしないと、これらの原子が不安定になります。
1 つの軌道は最大 2 つの電子を保持できます。フントの法則によれば、同じサブシェル内のすべての軌道は、ペアになる前にまず電子によって占有されます。これは、電子が最初に不対電子として満たされ、次に結合することを意味します。したがって、電子を軌道に割り当てるときは、この規則に従います。これは、同じサブシェルに電子対を持つ軌道と空の軌道がある場合、電子が負に帯電し、同じ軌道にあると互いに反発するため、不安定な構成になるためです。したがって、電子は、電子間の反発が最小になるように配置される傾向があります。

図 2:軌道を占める電子
さらに、この規則は、電子がその「スピン」に一致するように軌道に埋められることを説明しています。言い換えれば、同じサブシェルの単独占有軌道の電子は同じスピンを持っています。これらの電子が対になると、2 つの電子は、それらの間の反発を最小限に抑えるために反対のスピンを持ちます。電子対の一方の電子は「スピンアップ」し、もう一方の電子は「スピンダウン」します。

図 3:軌道内の電子のスピン
軌道が単独で占有されている場合、その電子は「スピンアップ」または「スピンダウン」のいずれかになります。しかし、その電子がペアになると、もう一方の電子はこの電子と反対のスピンを持つはずです。このように、反発は最小限に抑えられます。
アウフバウの法則とフントの法則の類似点
- アウフバウの原理とフントの法則はどちらも、原子のエネルギー準位が電子で満たされる順序を示しています。
アウフバウの法則とフントの法則の違い
定義
アウフバウの原理: アウフバウの原理は、原子のサブシェルが電子で満たされる順序を説明しています。
フンドの法則: フントの法則は、サブシェルの軌道が電子で満たされる順序を説明しています。
理論
アウフバウの原理: アウフバウの原理によれば、サブシェルは最低エネルギー レベルから最高エネルギー レベルまで満たされます。
フンドの法則: フントの法則によれば、軌道は最初に電子によって占有され、次にスピンに従って対になります。
エネルギーレベル
アウフバウの原理: アウフバウの原理は、電子がサブシェルを満たす方法を説明しています。
フンドの法則: フントの法則は、電子がサブシェルの軌道を満たす方法を説明しています。
反発
アウフバウの原理: アウフバウの原理は、電子間の反発の最小化について説明していません。
フンドの法則: フントの法則は、電子間の反発を最小限に抑える方法で電子がどのように満たされるかを示しています。
結論
アウフバウの原理とフントの法則の両方が、特定の原子の原子構造を開発する上で非常に重要です。ある原子の電子数が分かれば、上記の理論を使ってその原子の電子の配置パターンを決定することができます。アウフバウの法則とフントの法則の主な違いは、アウフバウの法則はサブシェルが電子で満たされる順序を示しているのに対し、フントの法則はサブシェルの軌道を電子が満たす方法を示していることです。







