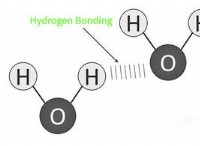
1。水素結合:
- 水素結合は、他のほとんどの物質と水を区別する重要な要因です。これは、水分子の非常に感動性の高い酸素原子が発生し、部分的な負電荷とわずかに陽性の水素原子を生成します。この極性は、1つの分子の陽性水素が別の分子の陰性酸素に引き付けられる水分子間の水素結合を可能にします。
- 水素結合は液体状態で最も強い。固体氷では、水素結合が硬い結晶構造を形成しますが、水蒸気(ガス状態)では、水素結合はより弱く、より動的です。
2。分子構造:
- 水の分子構造は、その特性を決定する上で重要です。酸素原子の周りの2つの水素原子と2つの孤立した電子の四面体配置は、曲がったまたは「V」形の分子を作成します。
- この分子ジオメトリは、水素原子に部分的な正電荷と酸素原子に部分的な負電荷を伴う極性分子をもたらします。水分子の極性は、その高い表面張力と多くの物質を溶解する能力の原因です。
3。分子間力:
- 分子間力は、隣接する分子間で作用する力です。水の場合、支配的な分子間力は水素結合です。ただし、分子間のより弱い引力であるファンデルワールス力もあります。
- 液体状態では、水素結合とファンデルワールスの力が一緒に働き、水分子を互いに近くに保持し、水を高密度と凝集します。氷では、水素結合が支配的な力であり、硬い結晶構造を作り出します。水蒸気では、分子間の距離が増加するため、ファンデルワールスの力は比較的強くなります。
ここに、その3つの状態の水の特性の要約があります。
solid(ice):
- 水素結合は、硬い結晶構造を形成します。
- 分子は、水素結合によって強くまとめられています。
- 開いた結晶構造による低密度。
- 脆くて硬い。
- 熱導体が不十分で、熱容量が低い。
液体(水):
- 水素結合は動的ネットワークを形成し、分子がより自由に移動できるようにします。
- 分子は、水素結合とファンデルワールスの力によって一緒に保持されます。
- 分子の閉鎖による高密度。
- 液体の水は、表面の張力と極性が高くなっています。
- 優れた熱導体と高熱容量。
ガス(水蒸気):
- 水素結合はより弱く、より動的であり、分子が独立して移動できるようにします。
- 分子は、主にファンデルワールスの力によって結合されます。
- 分子間の距離の増加による低密度。
- 水蒸気は目に見えず、表面張力が低い。
- 熱導体が不十分で、熱容量が低い。
化学、生物学、環境科学、物質科学など、さまざまな物質状態における水のユニークな特性を理解することは、さまざまな科学分野で重要です。また、寒い気候での氷の形成から大気中の水の蒸発まで、私たちの日常生活において重要な役割を果たしています。