プリオンは、病気を引き起こす可能性のある立体的な形状を変化させるタンパク質です。プリオンは脳内に存在し、プロテアーゼに耐性があります。プリオンの機能は完全には理解されていませんが、細胞内シグナル伝達と細胞接着に関与していると考えられています。プリオンは受容体を介して細胞に取り込まれますが、その形成過程は完全には理解されていません.
病気やその原因について考えるときはいつでも、バクテリアやウイルスなどの答えが頭に浮かぶことがよくあります。しかし、核酸や細胞小器官を持たない特定の悪党がいると言ったらどうでしょう!それは実際には生物でさえありません。それは単一の生体分子 – タンパク質です!想像してみてください、数が増えて病気を引き起こす可能性のあるタンパク質の単一分子に他なりません!しかし、タンパク質はどのように複製できるのでしょうか?特に、酵素や細胞機構を一切使用していません!まあ、それは実際には複製されませんが、数は増えます!クレイジーですね。
これらの狂ったタンパク質は プリオン と呼ばれます スタンリー・プルシナー博士によって造られた用語。彼と彼のチームは、タンパク質自体を分離しました。プルシナー博士は、プリオンに関する研究により、1997 年にノーベル医学賞を受賞しました。 何年もの間、プリオンは分離するのが非常に困難であったため、研究者にとって謎にほかなりませんでした。それらの機能はまだ完全には理解されていません!
プリオンは体中、特に脳に存在します。では、なぜこれらの同じタンパク質が問題を引き起こしているのでしょうか?そして、それらがすべての人に存在する場合、なぜ私たち全員がその悪影響の影響を受けないのでしょうか?簡潔な答え?違いは構造にあります!私たちの体内にあるプリオンタンパク質と、病気の原因となるプリオンタンパク質は構造が異なります。構造が機能とどのように関係しているのか疑問に思っていますか?簡単に見てみましょう。
タンパク質の構造
プリオンに飛び込む前に、タンパク質の構造とその機能との関係を理解する必要があります。タンパク質には、実際には 4 つのレベルの構造があります。タンパク質は一連のアミノ酸から作られ、これらの鎖 (ポリペプチドとしても知られています) が一次構造を形成します。これらのアミノ酸と、それらの間の水素結合による相互作用に応じて、2 種類の二次構造、すなわちアルファヘリックスとベータシートが形成されます。これらの構造は、三次元構造に折り畳まれます。折り畳みは、疎水性相互作用によって駆動されます。構造は、塩橋 (水素結合とイオン結合の組み合わせ) とジスルフィド結合を介してそのまま保持されます。最後に、複数のサブユニットが集まって四次構造を形成します。この構造は単一のユニットとして機能し、さまざまな機能を実行します。
これは、アミノ酸配列が機能タンパク質の構造を決定することを意味します。次は構造と機能のつながり!タンパク質は、標的にランダムに結合しません。それらには、その作業をバインドして継続するために使用される特定のアクティブ サイトがあります。結局、構造が変われば活性部位の形が変わる。これにより、タンパク質がその仕事をすることができなくなります!また、場合によっては、構造の変化が機能を変化させ、問題を引き起こす可能性があります。これは、特定のタンパク質を意図していない標的に結合する可能性があるためです!
さあ、プリオンを掘り下げましょう!
プリオンの構造
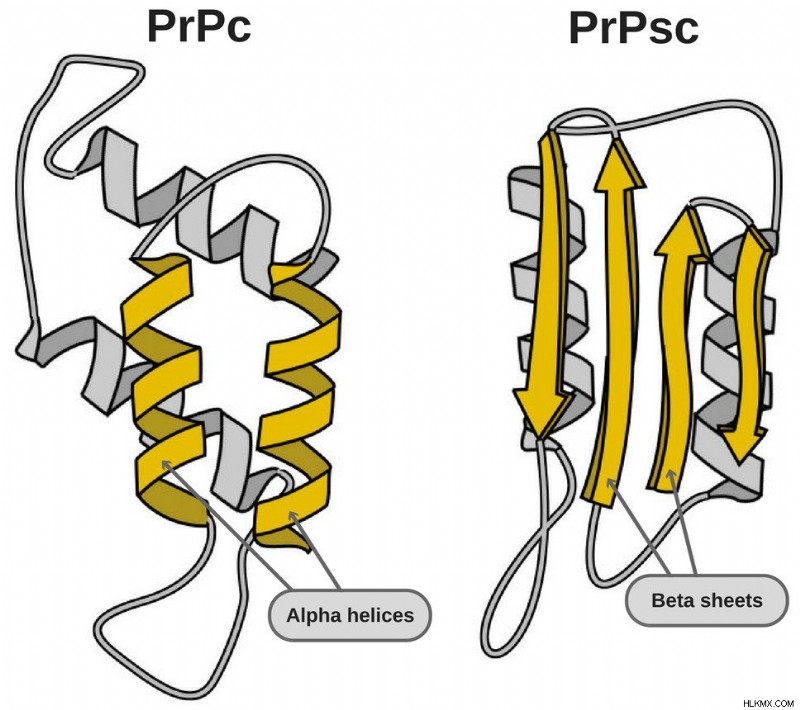
私たちの体にあるプリオンタンパク質(PrP)と病気の原因となるタンパク質は構造が異なります。それらのいくつかは、プロテアーゼ (タンパク質を分解する酵素) に対しても耐性があります。両方のアイソフォームを見ていきます。
- PrPC – これらのタンパク質は、細胞の膜に見られます。それらは、細胞内シグナル伝達および細胞接着において重要な役割を果たすと考えられています。ただし、その機能に関連する問題は解決されていないため、研究が進行中です。
- PrPSc – この病気の原因となるプリオンは、プロテアーゼ耐性です。構造に影響を与えることで PrPC を変化させます。構造の変化は、タンパク質との相互作用と相互接続の方法を変化させます!これらのプリオンの 3 次元構造は知られていませんが、私たちが知っていることは、通常のアルファヘリックス構造よりも多くのベータシートを持っているということです.このプリオンは、高度に構造化されたアミロイド線維も形成します。ファイバーの末端は、他の遊離タンパク質が結合するためのテンプレートとして機能します。類似のアミノ酸を持つ類似のプリオンのみが結合できます。異種間の結合は非常にまれですが、可能です。
関数
プリオンの機能を理解するのは簡単なことではありません。技術の進歩にもかかわらず、体内での機能の明確な証拠は得られていません。私たちの科学者が取ったアプローチは、マウスから遺伝子を接合し、変化に注意することでした.基本的に、これは、PrP を除去した場合、何か問題が発生しないかどうかを確認するためのものでした。このような実験では不明確な答えが得られ、マウスはわずかな異常しか示していません.
2004 年の研究では、マウスに PrP 遺伝子が欠如していると、海馬の長期増強が変化したことが示されました。また、別の 2006 年の記事では、骨髄の自己再生には幹細胞での PrP 発現が必要であることが示されました。また、PrP の欠如により、細胞は細胞枯渇に対して敏感になりました。
プリオンはどのように感染して複製するのですか?
プリオンの感染と複製のトピックは、最も物議をかもしたものです。考えてみれば、タンパク質分子は転写や翻訳を使わずにどうやって数を増やすことができるのでしょうか?細胞機構がなければ、複製のタスクは不可能になるはずです。しかし、プリオンはまさにそれを行います!
機能と同様に、その複製メカニズムを解明することは簡単な作業ではありませんでした。細胞の感染 in vitro 困難であり、ほとんどが失敗に終わっています。細胞 PrP を発現する細胞株 (実験に使用するもの) のほとんどは、プリオン感染に耐性があります。特定の細胞株が PrP 株に感受性がある場合でも、他の株には耐性がある可能性が高いです。研究者が直面するもう 1 つの問題は、PrP(Sc) を確実に検出できる抗体がないことです。これらの問題が組み合わさって、プリオンの複製を理解するのが難しくなっています.
プリオンの摂取
感染のプロセス全体を理解するための最初のステップは、プリオンがどのように細胞に取り込まれるかを知ることです。細胞株によるプリオンの受容率は、(プリオンを含む)準備がどのように行われたか、およびそれらが薬剤/化学物質によって処理されたかどうかによって異なります.多くの研究は、プリオンに耐性があることが知られている菌株が PrP(Sc) を取り込んでいたことを示しています。これにより、PrP(Sc) の受容体は耐性細胞株にも存在すると彼らは考えました。細胞へのプリオンの取り込みに影響を与えることが示されている受容体は、LRP/LR、HS、およびプロテオグリカンです。 LRP/LR受容体を欠損したノックアウトマウスを用いた場合、プリオンの摂取量の低下が観察されました。このようなテストにより、これらの受容体が重要な役割を果たしているという事実が確認されました.
プリオンを取り込む別の方法は、マクロピノサイトーシスです。マクロピノサイトーシス阻害剤を使用してプロセスをブロックするテストが実施され、再び取り込みの低下が観察されました。これらは、取り込みが発生する既知の方法のほんの一部です。
プリオンの形成
形成のプロセスは完全には理解されていませんが、研究者はその形成に影響を与えるさまざまな要因を調べており、形成に関与している可能性があります。調査によると、これは迅速なプロセスであり、数分から数時間で開始されます。 PrP(Sc) 産生は多くの場合一過性であり、感染症には至りませんでした。プリオンの形成に重要なものの 1 つは脂質ラフトです。フィリピン薬による治療により、プリオンの形成が停止したことが観察されました。フィリピンの薬はコレステロールを枯渇させ、脂質ラフトを破壊します。
PrP(Sc)は主に細胞の内側に見られ、細胞表面には微量しか存在しません。 PrP(C) が PrP(Sc) に変換されるには、原形質膜に送られる必要があります。 PrP(C) を除去すると、PrP(Sc) の蓄積が細胞内で減少することが観察され、別の実験では、PrP(C) の細胞膜への輸送障害が細胞を効果的に治癒させました。 )形成。 GPI (グリコシルホスファチジルイノシトール) 部分を欠く細胞でさえ、細胞内での PrP(Sc) 形成を維持できませんでした。
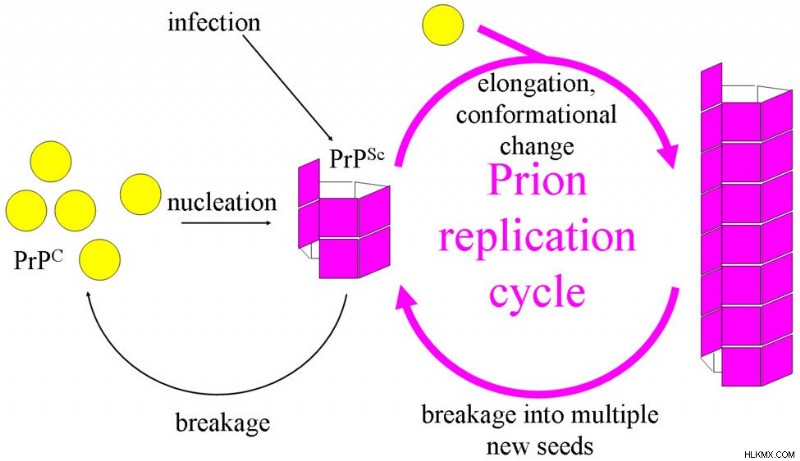
プリオンの複製 (写真提供:Joannamasel / Wikimedia Commons)
プリオンはどのように細胞から細胞へと広がるのですか?
プリオンを細胞に拡散させる主な方法は 2 つあります。最初の方法は細胞培養培地への PrP(Sc) の放出によるもので、2 番目の方法はエキソソームでの放出です。 Kanu と同僚による研究は、細胞間感染が細胞の近接または直接接触に依存していることを示しました。いくつかの研究では、PrP(Sc) が培養液に放出されましたが、近くの細胞への伝達が優先されました。細胞から細胞への感染の正確な方法はよくわかっていませんが、最近の研究では、細胞質ブリッジが関与していることが示されています。これらのブリッジは、アクチンで形成されたトンネル チューブとして知られており、細胞間コミュニケーションに役立ちます。
プリオン病
プリオン病 (総称して伝染性海綿状脳症として知られている) は、人間と他の動物の両方に影響を与える可能性のある複数の状態で構成されています。人間に影響を与える最も一般的に知られているプリオン病は、クロイツフェルト-ヤコブ病 (CJD) とそのバリエーションです。その他の既知の病気には、スクレイピー (羊) と牛海綿状脳症 (一般に狂牛病として知られている) があります。
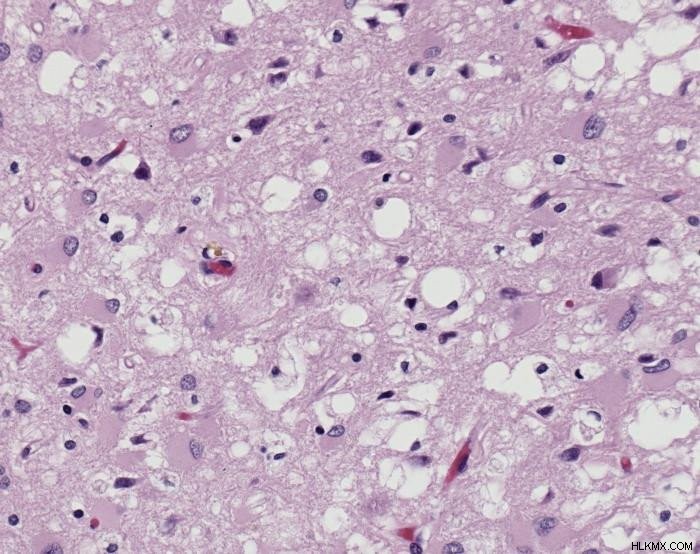
脳組織 – 変種クロイツフェルト・ヤコブ病。 (写真提供:Sherif Zaki; MD; PhD; Wun-Ju Shieh; MD; PhD; MPH / ウィキメディア コモンズ)
プリオンは、細胞外の細胞外空間に蓄積することにより、神経変性損傷を引き起こします。これは中枢神経系で起こります。さらに、それらが集まってアミロイド線維を形成します。これはニューロンにとって有毒であり、ニューロンを死に至らしめ、組織に穴を残し、海綿状の外観を与えます.
研究によると、私たちの体にはプリオンを分解する方法が 2 つあります。 1 つ目はリソソーム分解、2 つ目はオートファジーです。では、なぜプリオンは依然として私たちに影響を与えているのでしょうか?プリオンは賢いので、これらのメカニズムを取り出して増殖できるようにします!たとえば、Rab7 はリソソームの成熟に関与するタンパク質ですが、Rab7 はプリオンに感染した細胞では減少したレベルで存在することが観察されています。 Rab7 レベルが低下すると、リソソームの成熟に影響します。これは、プリオンを分解するために存在するリソソームが少なくなることを意味します!プリオンはオートファジーにも影響を与えます。これは、プリオンが前進してニューロンに影響を与えるのをさらに助けます。これらの効果は、今度は私たちの細胞に影響を与え、プリオンが細胞死を誘発するのを助けます.この細胞死の誘導は、ミトコンドリア膜の脱分極を引き起こし、プロセスを速めます!
全体として、プリオンは病気を引き起こす最も謎めいた病原体です。まだ不明な点が多いため (機能、病態生理学、その他多くのこと)、今後の研究で何が明らかになるか楽しみです。







