世界保健機関の推定では、今日、2 億 2,500 万人以上が B 型肝炎ウイルス (HBV) に感染しており、その結果、毎年 85 万人以上が死亡しています。効果的で安価なワクチンは感染を防ぐことができますが、肝疾患の主な原因であるウイルスは、感染した母親から出生時に新生児に簡単に感染します.効果。そのため先月、イギリスのヨーク大学の数学者である Reidun Twarock が、リーズ大学の生物化学教授である Peter Stockley とそれぞれの同僚とともに、HBV がどのように自己集合するかについての洞察を発表したことは注目に値します。彼らは、その知識が最終的にウイルスに対抗できるようになることを望んでいました.
この 2 月にチームが風邪に関連するウイルスの自己組織化に関する同様の発見を発表したため、彼らの業績はさらに注目を集めました。実際、近年、トワロック、ストックリー、およびその他の数学者は、さまざまなウイルスのアセンブリの秘密を明らかにするのに役立ちました.
彼らの成功は、生物学的実体の理解に数学的原理を適用することに成功したことを表しています。また、最終的には、ワクチンや抗ウイルス剤を開発するための、潜在的に安全な新しい方法を切り開くことで、一般的なウイルス性疾患の予防と治療に革命を起こすのに役立つかもしれません.
測地線の洞察
1962 年、生物学者と化学者のデュオであるドナルド キャスパーとアーロン クルーグは、ウイルスの構造組織に関する重要な論文を発表しました。紙に掲載された一連のスケッチ、モデル、X 線回折パターンの中に、発明者で建築家のリチャード・バックミンスター・フラーが設計した建物の写真がありました。そして、部分的には、Caspar と Klug の理論に影響を与えた測地線ドームの格子構造、六角形と五角形から組み立てられた凸多面体、それ自体が三角形に分割されたものでした。
フラーがドームの利点を宣伝していたとき、つまり、その構造が他の形状よりも安定性と効率性を高めていることを宣伝していたのと同じ時期に、キャスパーとクルーグはウイルス学の構造上の問題を解決しようとしていました。 、とりわけジェームズ・ワトソン、フランシス・クリック、ロザリンド・フランクリン。ウイルスは、ゲノム物質を保護し、宿主細胞への挿入を容易にするキャプシドと呼ばれるタンパク質シェルにパッケージ化された DNA または RNA の短いストリングで構成されます。もちろん、ゲノム材料はそのようなキャプシドの形成をコード化する必要があり、DNA または RNA のより長いストランドはそれらを保護するためにより大きなキャプシドを必要とします。ウイルスに見られるような短いストランドがこれを達成できるとは思えませんでした.
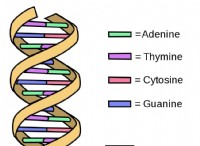
その後、DNA の二重らせんに関する研究から 3 年後の 1956 年、ワトソンとクリックはもっともらしい説明を思いつきました。ウイルスのゲノムには、限られた数の異なるキャプシドタンパク質に対する指示のみが含まれている可能性があり、これは、おそらくウイルスのキャプシドが対称的であることを意味していました。対称パターン。 X線回折と電子顕微鏡を使用した実験により、これが実際に当てはまることが明らかになり、ウイルスは主にらせん状または20面体の形状であることが明らかになりました.前者はトウモロコシの穂に似た棒状の構造で、後者は球に近似した多面体で、20 個の三角形の面が接着されたものでした。
正多面体の 1 つであるこの 20 面の形状は、見た目が変わらないように見えることなく、60 通りの方法で回転させることができます。また、対称軸に等しく関連する 60 の同一のサブユニット (各三角形の面に 3 つずつ) の配置も可能になります。これは、60 のタンパク質で構成されるキャプシドを持つ小さなウイルスに完全に機能するセットアップです。
しかし、ほとんどの二十面体ウイルス キャプシドははるかに多数のサブユニットで構成されており、このようにタンパク質を配置しても 60 を超えることはありません。明らかに、より大きなウイルス キャプシドをモデル化するには新しい理論が必要でした。そこにカスパーとクルーグが登場しました。バックミンスター・フラーの建築作品について最近読んだ二人は、研究しているウイルスの構造と関連性があるかもしれないことに気付き、それがひらめきました。 20 面体をさらに三角形に分割し (より正式には、20 面体に六角形の格子を適用し、各六角形を 6 つの三角形に置き換えます)、それらの三角形の角にタンパク質を配置すると、これらの種類のウイルスのより一般的で正確な図が得られました。ように見えた。この分割により、サブユニットが隣接するサブユニットとの結合方法の違いを最小限に抑え、格子上で 5 重または 6 重の位置を形成する「準同等性」が可能になりました。
このような微視的なジオデシック ドームは、すぐに 20 面体ウイルスを表す標準的な方法になり、しばらくの間、Caspar と Klug がこの問題を解決したように見えました。しかし、1980 年代と 90 年代に実施されたいくつかの実験では、この規則に対するいくつかの例外が明らかになりました。特に、ポリオーマウイルス科およびパピローマウイルス科と呼ばれる癌の原因となるウイルスのグループで顕著でした。
ウイルスの生物学への洞察を提供するために、純粋数学の理論によって可能になった外部アプローチが再び必要になりました.
カスパーとクルーグの足跡をたどる
約 15 年前、トワロックは、ウイルスが対称構造を実現するさまざまな方法についての講義に出くわしました。彼女は、球体で取り組んできた対称技術のいくつかをこれらのウイルスに拡張できるかもしれないと考えました。 「それは雪だるま式になりました」とトワロックは言いました。彼女と彼女の同僚は、構造の知識があれば、「ウイルスがどのように機能し、どのように集合し、どのように感染し、どのように進化するかを理解することに影響を与えることができる」ことに気付きました。彼女は振り返りませんでした。それ以来、彼女は数理生物学者として働き、群論と離散数学のツールを使用して、Caspar と Klug が中断したところから続けています。 「私たちはこの統合的で学際的なアプローチを実際に開発しました」と彼女は言いました。「数学が生物学を動かし、生物学が数学を動かします。」
Twarock はまず、Caspar と Klug の研究では説明できなかったキャプシド サブユニットの位置を特定できるように、使用できる格子を一般化したいと考えました。たとえば、ヒトパピローマウイルスのタンパク質は、六角形ではなく、五角形の構造で配置されていました。ただし、六角形とは異なり、正五角形は正三角形から構築することも、平面をテッセレーションすることもできません。サーフェスを並べて並べて並べると、必然的にギャップとオーバーラップが発生します。
そこでトワロックは、1970 年代に開発された、凧とダーツと呼ばれる 4 面の図形を合わせて 5 回対称の平面を並べる数学的手法であるペンローズ タイリングに目を向けました。ペンローズ タイリングによって生成されたパターンは周期的に繰り返されないため、2 つの構成要素の形状を隙間なくつなぎ合わせることができます。 Twarock は、高次元空間 (この場合は 6 次元の格子) から対称性を 3 次元部分空間にインポートすることで、この概念を適用しました。この射影は格子の周期性を保持しませんが、ペンローズ タイリングのように長距離秩序を生成します。また、Caspar と Klug が使用する表面格子も含まれます。したがって、Twarock のタイリングは、Caspar と Klug の分類を回避したポリオーマ ウイルスとパピローマ ウイルスを含む、より広い範囲のウイルスに適用されました。
さらに、Twarock の構造は、キャプシドのタンパク質サブユニットの位置と方向を示すだけでなく、サブユニットが相互に、また内部のゲノム物質とどのように相互作用するかについてのフレームワークも提供しました。 「これは私たちが非常に大きな貢献をした場所だと思います」とトワロックは言いました。 「コンテナの対称性について知ることで、ゲノム物質の非対称組織の決定要因と、それをどのように組織化する必要があるかについての制約をよりよく理解できます。私たちは、ゲノムに秩序、またはその秩序の残骸があるはずだという考えを実際に浮かび上がらせた最初の人でした。」
それ以来、Twarock はこの一連の研究を追求してきました。
カプシド形成におけるウイルスゲノムの役割
Caspar と Klug の理論はカプシドの表面にのみ適用され、内部には適用されませんでした。そこで何が起こっているのかを知るために、研究者はクライオ電子顕微鏡法やその他のイメージング技術に目を向けなければなりませんでした。トワロックのタイリング モデルはそうではない、と彼女は言いました。彼女と彼女のチームは、今回はグラフ理論を使用して、ウイルス アセンブリ経路の組み合わせ制約を探し始めました。その過程で、彼らは、RNA ウイルスでは、ゲノム物質がカプシドの形成において以前考えられていたよりもはるかに積極的な役割を果たしていることを示しました.
パッケージングシグナルと呼ばれる RNA 鎖に沿った特定の位置が、キャプシドの壁の内側から接触し、キャプシドの形成を助けます。バイオインフォマティクスだけでこれらのシグナルの位置を特定するのは非常に難しい作業ですが、Twarock は、ハミルトニアン パスと呼ばれるタイプのグラフに基づく分類を適用することで、それを簡素化できることに気付きました。パッケージ化シグナルが、RNA ストリングに沿った粘着性の断片であると想像してください。それらの 1 つは他のものより粘着性があります。タンパク質が最初に付着します。そこから、新しいタンパク質が他の粘着性のある断片と接触し、それ自体が元に戻ることのない秩序だった経路を形成します。つまり、ハミルトニアン パスです。
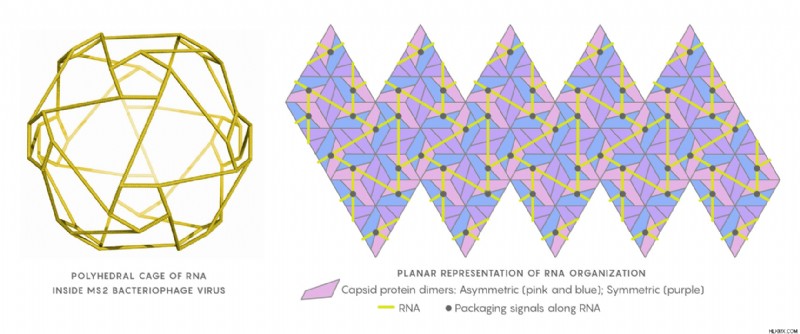
トワロックと彼女のチームは、RNA が隣接する RNA キャプシド結合部位に接触できる局所配置に特定の制約を課すキャプシドの形状と相まって、ハミルトニアン パスのサブセットをマッピングして、パッケージング シグナルの潜在的な位置を記述しました。トワロック氏によると、見込みのないものを取り除くことは「行き止まりを処理することの問題」でした。効果的かつ迅速な組み立てを可能にする、妥当かつ効率的な配置は、予想よりも限られていました。研究者らは、多くの RNA キャプシド結合部位がすべてのウイルス粒子に存在する必要があり、おそらくゲノム構成の保存された特徴であると結論付けました。もしそうなら、その部位は抗ウイルス療法の良い新しい標的になるかもしれません.
Twarock と彼女の同僚は、リーズの Stockley のチームと協力して、このモデルを使用して、バクテリオファージ MS2 とサテライト タバコ モザイク ウイルスから始めて、いくつかの異なるウイルスのパッケージング メカニズムを描写しました。彼らは 2013 年に Twarock の数学的ツールを使用して MS2 にパッケージング シグナルが存在することを予測し、2015 年にそれらの主張を裏付ける実験的証拠を提供しました。この 2 月、研究者は、ピコルナウイルス ファミリーの一部であるヒト パレコ ウイルスの配列特異的なパッケージング シグナルを特定しました。 、これには風邪が含まれます。そして先月、彼らは B 型肝炎ウイルスの組み立てに関する洞察を発表しました。彼らは、アルファウイルスを含む他のいくつかのタイプのウイルスに対して同様の作業を行うことを計画しており、そのようなウイルスがどのように進化するかをよりよく理解するために、その調査結果を適用したいと考えています.
幾何学を超えて
Twarock のチームが 2 月にパレコ ウイルスに関する発見を発表したとき、見出しは彼らが風邪の治療法に近づいていると主張しました。それは正しくありませんが、Stockley とのパートナーシップで念頭に置いてきた目標です。
最も直接的な応用は、これらのパッケージングシグナルを破壊する方法を見つけて、キャプシド形成を妨害し、ウイルスを脆弱なままにする抗ウイルス剤を作成することです.しかし、Stockley は、治療の前に予防に焦点を当て、別の道を歩むことを望んでいます.ワクチン開発は長い道のりを歩んできましたが、利用可能なワクチンの数は、脅威をもたらす感染症の数に比べて見劣りします.ストックリー氏は、「数百の感染症に対して人々にワクチンを接種したいと考えています」と述べましたが、承認されたワクチンは数十しかありません.安定した非感染性の免疫原を作成して、免疫系を本物に備えるには限界があります。現在、承認されているワクチンの戦略は、化学的に不活化されたウイルス (免疫システムがまだ認識できる死んだウイルス) または弱毒化された生きたウイルス (その効力の多くを失うように作られた生きたウイルス) のいずれかに依存しています。前者はしばしば短命の免疫しか提供しませんが、後者は弱毒化ウイルスから毒性形態に変換されるリスクを伴います. Stockley は 3 番目のルートを開きたいと考えています。 「なんらかの複製ができるが、病的な特徴を持たないものを作ってみませんか?」彼は尋ねました。
4 月に開催された Microbiology Society Annual Conference で発表されたポスターの中で、Stockley、Twarock、およびその他の研究者は、現在焦点を当てている分野の 1 つについて説明しています。それは、パッケージ化シグナルと自己組織化に関する研究を使用して、合成ウイルスの世界を調査することです。キャプシド形成を理解することで、ウイルス様粒子 (VLP) を合成 RNA で操作できる可能性があります。これらの粒子は複製できませんが、免疫系がウイルスのタンパク質構造を認識できるようになります。理論的には、VLP は弱毒化された生きたウイルスよりも安全であり、化学的に不活化されたウイルスよりも長期間にわたって優れた保護を提供する可能性があります。
トワロックの数学的研究は、ウイルス以外にも応用されています。ブラウン大学の数学者 Govind Menon は、自己組織化マイクロおよびナノテクノロジーを研究しています。 「合成自己組織化に関する数学的文献は非常に少ないです」とメノンは言いました。 「しかし、ウイルスの自己組織化を研究するモデルは数多くありました。私はこれらのモデルの研究を開始し、合成自己組織化をモデル化するのに十分な柔軟性があるかどうかを確認しました。私はすぐに、離散幾何学に根ざしたモデルが [私たちの研究] により適していることを発見しました。 Reidun の作品はこの流れに沿っています。」
ニューヨーク大学クーラント数理科学研究所の数学者ミランダ・ホームズ=セルフォンは、トワロックのウイルス研究と、溶液中に浮遊する微小粒子が自己組織化する方法に関する彼女自身の研究との間に関連性があると考えています。その関連性は、彼女がトワロックの調査の貴重な側面の 1 つと見なしているもの、つまり生物学の問題に彼女の専門知識を適用する数学者の能力を物語っています。
「生物学者と話すと、彼らが使用する言語は、物理学や数学で使用する言語とは大きく異なります。質問も違います。」数学者にとっての課題は、生物学に情報を与える答えを伴う質問を探す意欲に関係しています。トワロックの本当の才能の 1 つは、「その学際的な仕事をしていることです」と彼女は言いました。