主な違い アルファ チューブリンとベータ チューブリンの間では、アルファ チューブリンはほぼ完全に脱チロシン化されていますが、ベータ チューブリンは 10% しかリン酸化されていません。 .さらに、脱チロシン化は、アルファ チューブリンで発生する翻訳後修飾の形態を指し、ベータ チューブリンのリン酸化は C 末端ドメインの Ser441 で発生します。さらに、GTP は常にアルファ チューブリンに結合しますが、ベータ チューブリンの GTP はマイクロフィラメントと交換する傾向があります。
アルファ チューブリンとベータ チューブリンは、微小管の 2 つの主要な構成要素であり、有糸分裂、繊毛運動、べん毛運動などの多くの細胞プロセスに関与しながら、細胞骨格構造の形成に関与する非常に不均一な分子です。 、細胞内輸送、および細胞の形態と極性の定義。
対象となる主な分野
1.アルファチューブリンとは
– 定義、構造、役割
2. βチューブリンとは
– 定義、構造、役割
3.アルファ チューブリンとベータ チューブリンの類似点は何ですか
– 共通機能の概要
4.アルファチューブリンとベータチューブリンの違いは何ですか
– 主な違いの比較
主な用語
アルファ チューブリン、ベータ チューブリン、細胞骨格、GTP、リジン、マイクロフィラメント、微小管、翻訳後修飾
アルファ チューブリンとは
アルファ チューブリンは、細胞骨格の形成に重要な役割を果たす微小管の 2 つのタンパク質成分の 1 つです。また、微小管は、細胞分裂を含むいくつかの細胞イベントに参加します。一般に、微小管の 2 番目のタンパク質成分である α チューブリンと β チューブリンはいずれも、3 つの機能ドメインからなる球状タンパク質です。それらは、N末端ドメイン、中間ドメイン、およびC末端ドメインです。ここで、N 末端ドメインは 5 つのアルファ ヘリックスと 6 つの平行なベータ ストランドで構成され、ロスマン フォールドを形成します。 GTP 分子は N 末端ドメインのベースにあります。
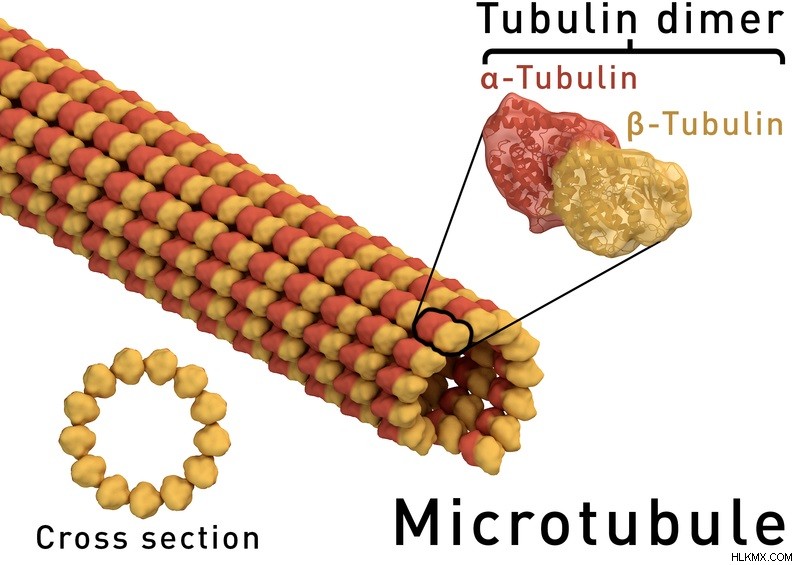
図 1:微小管構造
一方、中間ドメインは 3 つのアルファ ヘリックス、ベータ シート、さらに 2 つのヘリックスで構成されています。それはタキソール結合ドメインを形成します。通常、タキソールは、低温解重合および老化に対してシートを安定化させる役割を担う配位子です。ただし、C末端は完全にアルファヘリックスで構成されており、他の2つのドメインと重複するプロトフィラメント「クレスト」の形成に関与しています。これにより、他の関連タンパク質やモータータンパク質が微小管に結合できるようになります。
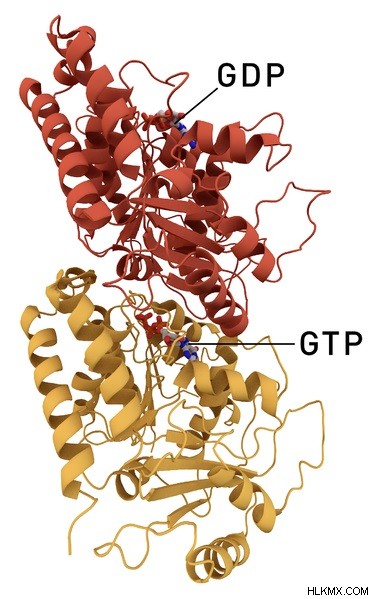
図 2:α および β チューブリン構造
さらに、微小管内のアルファ チューブリンの主な重要性は、GTP 分子の結合部位を提供することです。チューブリン二量体がプラス端に付加されると、この GTP は GDP に加水分解されます。また、GTP の加水分解は、α チューブリンの E サイトで発生します。この加水分解は、254 アミノ酸位置にあるアスパラギン酸残基によって促進されます。
ベータ チューブリンとは
前述のように、ベータ チューブリンは微小管の 2 番目のタンパク質成分です。 254 アミノ酸の位置にリジン残基が含まれています。リジンは、N サイトの GTP リン酸基と相互作用することにより、モノマー間相互作用を強化する役割を果たします。したがって、ベータチューブリンは微小管の構造を安定させるのに役立ちます。さらに、N末端ドメインとは別に、GTP分子はチューブリン分子のE(交換可能)部位に結合することができます。ただし、ベータ チューブリンの GTP は、マイクロフィラメントの重合と交換可能です。
アルファ チューブリンとベータ チューブリンの類似点
- アルファ チューブリンとベータ チューブリンは、微小管の 2 つの主要な構造要素です。
- 球状タンパク質です。
- また、どちらも分子量は約 50 kDa です。
- さらに、両方の分子が 40% の配列相同性を持っているため、アルファ チューブリンとベータ チューブリンの構造は類似しています。
- さらに、それらの構造には、アルファ ヘリックス、ベータ シート、およびランダム コイルが含まれています。
- それらのモノマー構造は、α ヘリックスに囲まれた 2 つの相互作用する β シートによって形成されます。
- さらに、それらは主に真核生物で発生しますが、原核生物にはチューブリンに関連するタンパク質がいくつかあります。
- さらに、どちらのタイプのタンパク質も翻訳後修飾を受けます。
- また、GTP はチューブリンの重合に必要なエネルギーを供給して微小管を形成します。
アルファ チューブリンとベータ チューブリンの違い
定義
アルファ チューブリンは GTP に結合した微小管の 2 つのタンパク質成分の 1 つを指し、ベータ チューブリンは微小管の 2 番目のタンパク質成分です。したがって、これがアルファ チューブリンとベータ チューブリンの根本的な違いです。
構造
アルファ チューブリンは 13% のアルファ ヘリックス、39% のベータ シート、48% のランダム コイルで構成され、ベータ チューブリンは 13% のアルファ ヘリックス、42% のベータ シートで構成されています。 、および 45% のランダム コイル。したがって、この構造は、アルファ チューブリンとベータ チューブリンの重要な違いです。
254 アミノ酸
さらに、アルファ チューブリンとベータ チューブリンのもう 1 つの違いは、アルファ チューブリンには 254 アミノ酸としてアスパラギン酸が含まれているのに対し、ベータ チューブリンには 254 アミノ酸としてリジンが含まれていることです。
254 アミノ酸の機能
また、254番目のアミノ酸の働きもαチューブリンとβチューブリンの違いになります。アルファ チューブリンの 254 アミノ酸は、E 部位でのヌクレオチドの加水分解の理想的な残基として機能しますが、ベータ チューブリンの 254 アミノ酸は、N 部位で GTP リン酸基と相互作用することにより、モノマー間相互作用を強化します。 /P>
GTP バインディング
さらに、GTP は常に α サブユニットに結合していますが、β サブユニットでは、GTP は重合するマイクロフィラメントと交換可能です。したがって、これがアルファ チューブリンとベータ チューブリンのもう 1 つの違いです。
翻訳後修飾
とりわけ、アルファ チューブリンとベータ チューブリンの主な違いは、アルファ チューブリンがほぼ完全に脱チロシン化されているのに対し、ベータ チューブリンの約 10% がリン酸化されていることです。
翻訳後修飾の性質
上記の違いから、脱チロシン化は C 末端チロシンの除去に関与し、新しく形成されたアルファ チューブリンの C 末端でグルタミン酸を露出させ、ベータ チューブリンのリン酸化を引き起こします。 C 末端ドメインの Ser441 で発生します。したがって、これはアルファ チューブリンとベータ チューブリンの違いでもあります。
結論
アルファ チューブリンは、微小管の 2 つのタンパク質成分の 1 つです。これは、翻訳後修飾としてほぼ完全に脱チロシン化された球状タンパク質です。また、アルファ チューブリンに結合した GTP は、チューブリンの重合にエネルギーを提供する役割を果たします。一方、ベータ チューブリンは微小管の 2 番目のタンパク質成分です。また、リン酸化されることもある球状タンパク質です。ベータチューブリンの主な機能は、モノマー間相互作用を強化することです。したがって、アルファ チューブリンとベータ チューブリンの主な違いは構造と機能です。