グラムをモルに変換するには、化合物の分子量を求め、化合物のグラム数を分子量で割る必要があります。
グラムをモルに変換するには、次の 2 つの手順が必要です:
ステップ 1:化合物の分子量を求めます。
ステップ 2:化合物のグラム数をその分子量で割ります。
特定の化合物のモル数を決定するために、最初に行う必要があるのは、問題の化合物の分子量 (または分子量) を見つけることです。それが終わったら、化合物の物理的な重さ (グラム単位) を決定する必要があります。これらの値の両方を取得したら、化合物の物理量を分子量で割る必要があります。
グラムからモルへの変換計算手順を詳しく説明する前に、基本事項を簡単にまとめておきましょう。
化学におけるモルとは?
物質のモルは、正確に 12 グラムの炭素 12 (約 6.022 x 1023 原子) に存在する原子と同じ数の基本単位を含む物質の質量として定義されます。
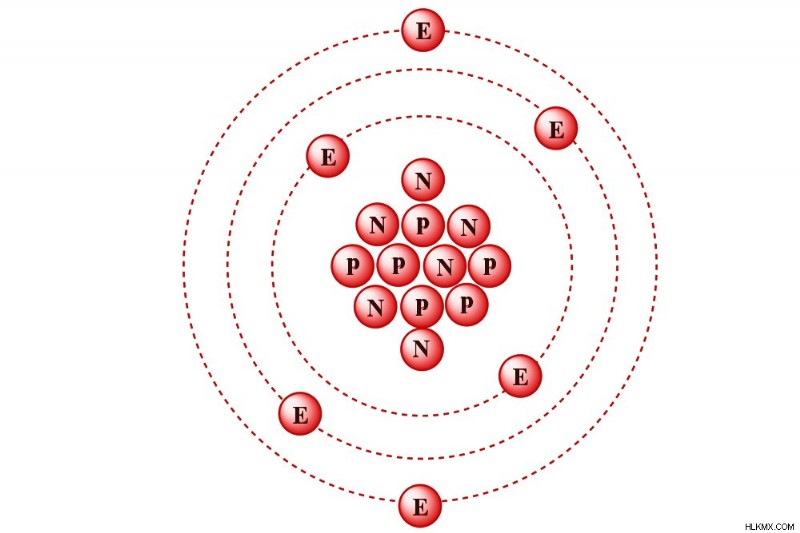
炭素 12 は、原子核に 6 つの陽子と 6 つの中性子を含む炭素同位体です。
また、(化学の) モルのより簡単で理解しやすい定義を述べたいと思います。
モルは化合物の測定単位です。距離、質量、時間などの物理量に測定単位 (それぞれメートル、グラム、秒) があるのと同じように、化学物質はモルで測定されます。つまり、「モル」は化学における量の単位であると言えます。つまり、特定の化学物質がどれだけ存在するかを示します。
化学におけるほくろを、人体に関連するほくろと混同しないように注意してください。前者は測定単位ですが、後者は皮膚細胞が集団で成長した皮膚上の黒い斑点です。

化学者が実験室で化学反応を行う場合、実際にプロセスを開始する前に、反応に関与するすべての化学物質が適切な量で使用されていることを確認したいと考えています。銀河間距離をセンチメートルではなく光年で測定する方がはるかに簡単で便利なのと同じように、原子を数十億や兆で数えるよりもモルで数える方が簡単です。
ここで、モルについて興味深いことがあります。あらゆる元素または化学物質の 1 モルは、常に同じ数です。たとえば、1 モルの水素と 1 モルの酸素には、どちらも約 6.022 x 1023 個の原子が含まれています。ただし、水素と酸素のそれぞれの質量は異なります。
化合物の場合も同様です。それらの分子量が何であれ、それらはすべて特定のモル数に対して同じ数の分子を含みます。つまり、1 モルのグルコースには 1 モルのメタンと同じ数の分子が含まれます。ただし、それらの質量は異なります。
モルが何であるかを理解したので、次は化合物に存在するモル数を決定する方法を見ていきます。ただし、問題の化合物の物理的重量が既にわかっている場合に限ります。
グラムからモルへの変換式
最初のステップは、扱っている化合物の分子量 (または分子量) を決定することです。化合物は、さまざまな元素の多数の原子で構成されており、それらを合わせた重量が化合物の分子量になります。
この概念をよりよく理解するために、NaCl (塩化ナトリウムまたは食塩) の例を考えてみましょう。
NaCl は、ナトリウム (Na) と塩化物 (Cl) の 2 つの原子で構成されています。ナトリウムの原子量は 22.98 ですが、塩素の原子量は 35.543 です。
NaCl の分子量 =ナトリウムの原子量 + 塩素の原子量
したがって、NaCl の分子量は 58.52 グラム/モルになります。
これは、化合物の分子量を決定する方法です。
次に、問題の化合物の「物理的」重量を見つける必要があります。この場合は塩化ナトリウムです。サンプルの重量は、物質をグラム単位で計量する装置である分析天秤 (「ラボ天秤」とも呼ばれます) を使用して測定できます。ほとんどの化学実験室では、化学物質の重量を測定するためにこの装置を手元に置いています。

分析天秤 Mettler ae-260 (写真提供:US DEA/Wikimedia Commons)
この場合、100 グラムの食塩のサンプルがあるとします。
化合物の分子量と物理量の両方が得られたら、簡単な式を使用してサンプルに存在するモル数を計算できます。
モル数 =化合物の重量 (グラム単位) / 化合物の分子量

この例では、NaCl の重量は 100 グラムで、その分子量は 58.52 g/モルです。したがって、与えられた NaCl のサンプルのモル数は 1.70 モル (100/58.52) になります。
別の例を見てみましょう – 50 グラムの水 (H2O) のサンプルです。
水の分子量は 18 g/mol です。
したがって、この水のサンプルのモル数は 2.78 モル (50/18) になります。
この式を使用して、任意の化合物の特定のサンプルに存在するモル数を決定できます。







