ヘンリーの法則は、ガスの分圧と溶液中のそのガスの濃度との間の数学的関係です。法律では、溶液に溶解するガスの量は、そのガスの分圧に比例すると述べています。
数学に関する方程式が非常に無味乾燥でありふれたものになる可能性があることは事実です。それらは、これらの概念や方程式が現実世界とのあらゆる種類の相関関係を失うほどの高度な抽象的思考につながることがあります。これは、非常に抽象的であるため、ヘンリーの法則に特に当てはまります。しかし、それが「法則」と呼ばれる理由があります。つまり、最も科学的かつ数学的に正確な方法で自然現象を説明するからです。それでは、ヘンリーの法則の基本的な理解を確立してみましょう。
理論的理解
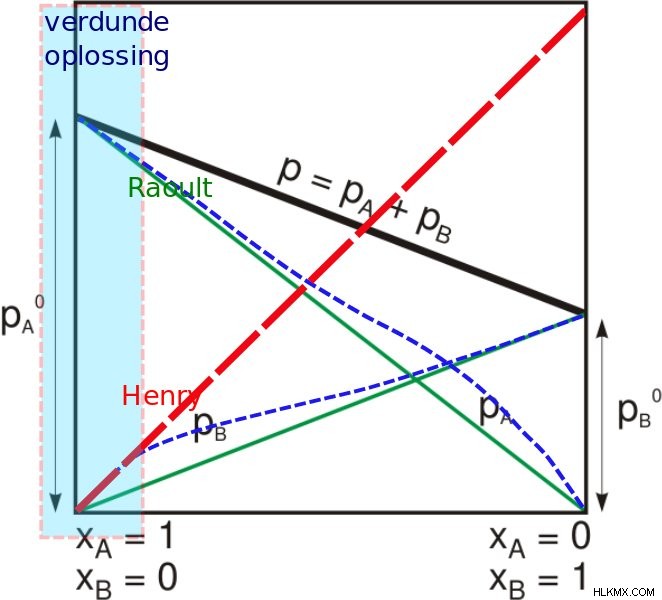
(写真提供:Jcwf/ウィキメディア・コモンズ)
気体が液体の表面と接触すると、溶液に入る気体の量はその気体の分圧に比例します。分析のために、気体と液体が水であると仮定しましょう。特定の温度で溶解するガスの量は、ガスが液体に及ぼす分圧に依存します。覚えておかなければならない簡単なことの 1 つは、溶解しているガスと溶解していないガスが平衡状態にあるということです。ヘンリーの法則のより単純な理論的根拠は、気体の分圧が 2 倍高い場合、平均して 2 倍の数の気体分子が水の表面に衝突するというものです。混合ガスの場合、ヘンリーの法則は、溶解するガスの量 (または複数のガス) を予測するのに役立ちますが、ガスによって溶解レベルが異なり、速度にも影響します。
方程式
ヘンリーの法則の 1 つの広範な適用について理解できたので、ヘンリーの法則を理解するために、より厳密な数学的アプローチを取りましょう。気体と液体は何らかの平衡関係に達します。
液体⇔気体
CsHe =パイ
さまざまな要素は、次の略語で表されます:
Cs =飽和濃度
He =ヘンリーの法則係数
Pi=ガスの分圧
ヘンリーの法則係数 (He) の標準単位は、atm⋅m3/mole で表されます。 P は atm で、飽和含有量の場合、Cs は mol/m3 で表されます。ヘンリーの法則係数が大きいほど、揮発性が高くなり、溶解度が低くなります。これは、周囲の圧力と温度に近い希釈溶液と非反応性ガスに有効です。イオン強度はヘンリー係数を増加させ、ガス溶解度を減少させます。
水中の溶存酸素と平衡
上記の方程式と現実世界との物理的な関係を理解できるように、非常に実用的な例を考えます。水に溶ける酸素の特定のケースを考えてみましょう。さて、溶存酸素が存在するようになったのには、主に 2 つの理由があります。第一の理由は、水草の光合成の副産物だからです。 2 つ目は、大気からの直接吸収によるものです。
水の酸素濃度が大気と平衡になるには、ヘンリーの法則で計算できます。 O2 の平衡定数は 769.23 です。水中の酸素の平衡定数は 0.00027 です。これは水面だけの平衡定数です。空気/水界面より下の水は、必ずしも大気中の酸素と平衡状態にあるとは限らず、示されているものとは異なる平衡定数を含む可能性があります。湖や海の表面の酸素濃度は、深部よりも高いことが知られています。酸素と水の関係について知っておくべき重要なことは、飽和率です。 .飽和率とは、水 1 リットルがその温度で保持できる酸素の総量に対する、水 1 リットルが保持できる酸素の量です。
浅瀬の流水は、空気とよく混ざり合うため、静水よりも酸素濃度が高くなります。温度と酸素濃度の間にも強い依存性があります。標高が高いほど大気圧が低くなるため、標高の高い水は、海面の水よりも溶存酸素が少なくなります。溶存酸素の量は、光合成生物が酸素を生成する日中に最も高くなります。水の温度が上昇するにつれて、酸素をそれ自体に溶解する能力はより困難になります。水生動物は日中や暑い夏の日に酸素レベルが低下しやすいため、これは特に危険です。水中の二酸化炭素飽和や、人間の血流中の酸素の計算など、ヘンリーの法則の他の応用もあります。ヘンリーの法則は、最も抽象的な概念でさえ、最も基本的な実用的なアプリケーションを持っていることを証明しています.







